Detection of specific antibody responses to vaccination in variable flying foxes (Pteropus hypomelanus)
- PMID: 18242703
- PMCID: PMC7172824
- DOI: 10.1016/j.cimid.2007.11.002
Detection of specific antibody responses to vaccination in variable flying foxes (Pteropus hypomelanus)
Abstract
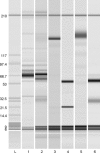
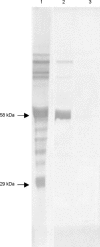
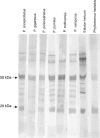
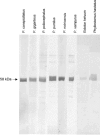
Megachiropteran bats are biologically important both as endangered species and reservoirs for emerging human pathogens. Reliable detection of antibodies to specific pathogens in bats is thus epidemiologically critical. Eight variable flying foxes (Pteropus hypomelanus) were immunized with 2,4-dinitrophenylated bovine serum albumin (DNP-BSA). Each bat received monthly inoculations for 2 months. Affinity-purified IgG was used for production of polyclonal and monoclonal anti-variable flying fox IgG antibodies. ELISA and western blot analysis were used to monitor immune responses and for assessment of polyclonal and monoclonal antibody species cross-reactivity. Protein G, polyclonal antibodies, and monoclonal antibodies detected specific anti-DNP antibody responses in immunized variable flying foxes, with protein G being the most sensitive, followed by monoclonal antibodies and then polyclonal antibodies. While the polyclonal antibody was found to cross-react well against IgG of all bat species tested, some non-specific background was observed. The monoclonal antibody was found to cross-react well against IgG of six other species in the genus Pteropus and to cross-react less strongly against IgG from Eidolon helvum or Phyllostomus hastatus. Protein G distinguished best between vaccinated and unvaccinated bats, and these results validate the use of protein G for detection of bat IgG. Monoclonal antibodies developed in this study recognized immunoglobulins from other members of the genus Pteropus well, and may be useful in applications where specific detection of Pteropus IgG is needed.
Les chauves-souris du groupe mégachiroptère sont importantes au point de vue biologique, parce qu’elles représentent un réservoir pour de nouvelles maladies humaines. La possibilité de détecter leurs anticorps contre des pathogènes spécifiques est donc critique au point de vue épidemiologique. Huit rousettes des iles (Pteropus hypomelanus) furent injectées avec de l’albumine de sérum bovin (2,4-dinitrophenylated bovine serum albumin, DNP-BSA) deux fois, à quatre semaines d’intervalle. Les anticorps IgG à affinité purifiée fûrent utilisés pour produire les anticorps mono- et polyclonaux IgG de chauves-souris. La réponse immunitaire des animaux et la réaction croisée entre les anticorps de différentes espèces furent mesurés avec l’ELISA et l’analyse de Western blot.
Au jour 56 apres l’injection, une magnification de la densité optique (optical density, OD405) entre 4 et 17 fois a été mesurée lorsque la protéine G fut utilisée comme agent. Quand des anticorps polyclonaux de lapins souris furent utilisés, la magnification fut de 1.4 a 2, alors que lorsque des anticorps monoclonaux de souris furent utilisés, la magnification fût de 1.7 a 7.
La protéine G, les anticorps mono et polyclonaux ont réussi a détecter une réponse immunitaire contre l’agent DNP chez les roussettes. Malgré que les anticorps polyclonaux aient réussi a faire une réaction croisée avec les IgG des chauves-souris, il y avait aussi beaucoup d’interférences.
Les anticorps monoclonaux ont très bien réagi avec 6 autres espèces du genre Pteropus, mais moins bien avec les epèces Eidolon helvum ou Phyllostomus hastatus. La protéine G fût utile pour distinguer les animaux vaccinés des naïfs, et ces résultats valident l’utilisation de la protéine G pour la détection des anticorps IgG chez les chauves-souris.
Les anticorps monoclonaux developpés dans ce projet a aussi pu détecter les immunoglobulines de d’autres membres de la famille Pteropus, et leur usage pourrait être utile dans certains cas où l’on a besoin de détecter les anticorps IgG.
Figures



Similar articles
-
Use of an ELISA for detection of antibody responses in Argentine boa constrictors (Boa constrictor occidentalis).Am J Vet Res. 2003 Apr;64(4):388-95. doi: 10.2460/ajvr.2003.64.388. Am J Vet Res. 2003. PMID: 12693526
-
A DESCRIPTION OF ARTERIAL BLOOD PRESSURE MEASUREMENT IN TWO SPECIES OF FLYING FOXES (PTEROPUS VAMPYRUS AND PTEROPUS HYPOMELANUS).J Zoo Wildl Med. 2019 Sep;50(3):665-671. doi: 10.1638/2018-0218. J Zoo Wildl Med. 2019. PMID: 33517637
-
Monoclonal antibodies for the measurement of class-specific antibody responses in the green turtle, Chelonia mydas.Vet Immunol Immunopathol. 1995 Jun;46(3-4):317-35. doi: 10.1016/0165-2427(94)05360-5. Vet Immunol Immunopathol. 1995. PMID: 7502491
-
Purification and characterisation of immunoglobulins from the Australian black flying fox (Pteropus alecto) using anti-fab affinity chromatography reveals the low abundance of IgA.PLoS One. 2013;8(1):e52930. doi: 10.1371/journal.pone.0052930. Epub 2013 Jan 7. PLoS One. 2013. PMID: 23308125 Free PMC article.
-
High prevalence of human anti-bovine IgG antibodies as the major cause of false positive reactions in two-site immunoassays based on monoclonal antibodies.J Immunoassay Immunochem. 2004;25(1):17-30. doi: 10.1081/ias-120027223. J Immunoassay Immunochem. 2004. PMID: 15038614
Cited by
-
Changing resource landscapes and spillover of henipaviruses.Ann N Y Acad Sci. 2018 Oct;1429(1):78-99. doi: 10.1111/nyas.13910. Epub 2018 Aug 23. Ann N Y Acad Sci. 2018. PMID: 30138535 Free PMC article. Review.
-
Livestock abundance predicts vampire bat demography, immune profiles and bacterial infection risk.Philos Trans R Soc Lond B Biol Sci. 2018 May 5;373(1745):20170089. doi: 10.1098/rstb.2017.0089. Philos Trans R Soc Lond B Biol Sci. 2018. PMID: 29531144 Free PMC article.
-
Antiviral immune responses of bats: a review.Zoonoses Public Health. 2013 Feb;60(1):104-16. doi: 10.1111/j.1863-2378.2012.01528.x. Epub 2012 Aug 1. Zoonoses Public Health. 2013. PMID: 23302292 Free PMC article. Review.
-
Nipah virus: epidemiology, pathology, immunobiology and advances in diagnosis, vaccine designing and control strategies - a comprehensive review.Vet Q. 2019 Dec;39(1):26-55. doi: 10.1080/01652176.2019.1580827. Vet Q. 2019. PMID: 31006350 Free PMC article. Review.
-
Identification of secreted and membrane-bound bat immunoglobulin using a Microchiropteran-specific mouse monoclonal antibody.Dev Comp Immunol. 2016 Dec;65:114-123. doi: 10.1016/j.dci.2016.06.024. Epub 2016 Jul 1. Dev Comp Immunol. 2016. PMID: 27377583 Free PMC article.
References
-
- Teeling E.C., Springer M.S., Madsen O., Bates P., O’Brien S.J., Murphy W.J. A molecular phylogeny for bats illuminates biogeography and the fossil record. Science. 2005;307(5709):580–584. - PubMed
-
- Jones D.P., Kunz T.H. Pteropus hypomelanus. Mamm Species. 2000;639:1–6.
-
- Jones K.E., Purvis A., Gittleman J.L. Biological correlates of extinction risk in bats. Am Nat. 2003;161(4):601–614. - PubMed
-
- Dobson A.P. What links bats to emerging infectious diseases? Science. 2005;310(5748):628–629. - PubMed
-
- Leroy E.M., Kumulungui B., Pourrut X., Rouquet P., Hassanin A., Yaba P., Délicat A., Paweska J.T., Gonzalez J.-P., Swanepoel R. Fruit bats as reservoirs of Ebola virus. Nature. 2005;438(7068):575–576. - PubMed
Publication types
MeSH terms
Substances
LinkOut - more resources
Full Text Sources

