[Human metapneumovirus]
- PMID: 18515017
- PMCID: PMC7126272
- DOI: 10.1016/j.patbio.2008.04.005
[Human metapneumovirus]
Abstract
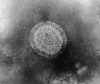
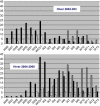
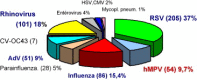
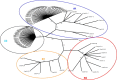
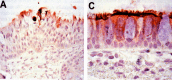
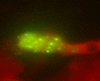
The human metapneumovirus (hMPV) is a new Pneumovirinae related to the avian metapneumovirus type C. hMPV genome differs from human respiratory syncytial virus (RSV) genome by the gene order and the lack of nonstructural genes. Two genetic sub-groups and four sub-types of hMPV are identified. hMPV infections evolve as regular winter outbreaks which have roughly the same size and overlaping RSV epidemics. Among hospitalized children in Caen, hMPV is detected in 9.7% of the cases after RSV (37%), rhinovirus (18%), influenza virus (14.5%), adenovirus (9%), and parainfluenza virus (5%). Most of hMPV infections are observed in children suffering from bronchiolitis, but the localization to lower respiratory tract and the severity of the disease are less frequent in comparison with RSV infections. hMPV is very difficult to isolate using cell culture. Up to now, the only way for hMPV diagnosis was the TS-CRP assays. But the recent apparition of direct antigenic tests allows us to get a fair, rapid, and economic diagnostic tool.
Le métapneumovirus humain (hMPV) est un nouveau Pneumovirinae apparenté au métapneumovirus aviaire du type C. Le génome du hMPV diffère de celui du virus respiratoire syncytial humain (RSV) par l’ordre des gènes et le manque des gènes non structuraux. Deux sous-groupes génétiques de hMPV et quatre sous-types ont été identifiés. Les infections à hMPV évoluent sous forme d’épidémies hivernales régulières, superposées à celle du RSV et d’importance à peu près égale d’une année sur l’autre. Chez les enfants hospitalisés à Caen, le hMPV est détecté dans 9,7 % des cas, après le RSV (37 %), les rhinovirus (18 %), les virus influenza (15,4 %), les adénovirus (9 %) et les virus parainfluenza (5 %). La plupart des infections à hMPV sont observées chez des enfants atteints de bronchiolites, mais par comparaison à l’infection à RSV, l’atteinte respiratoire basse et les signes de gravité sont moins fréquents. Le hMPV est très difficile à isoler en cultures des cellules. Le diagnostic a reposé jusqu’ici sur la détection moléculaire par RT–PCR. L’apparition récente des tests antigéniques permet de disposer aujourd’hui d’un test de diagnostic rapide, simple et économique.
Figures
References
-
- Akerlind B., Norrby B., Orvell C., Mufson M.A. Respiratory syncytial virus: heterogeneity of subgroup B strains. J Gen Virol. 1988;69:2145–2154. - PubMed
-
- Anderson L.J., Hierholzer J.C., Tsou C., Hendry R.M., Fernie B.F., Stone Y. Antigenic characterization of respiratory syncytial virus strains with monoclonal antibodies. J Infect Dis. 1985;151:626–633. - PubMed
-
- Akerlind B., Norrby E. Occurrence of respiratory syncytial virus subtypes A and B strains in Sweden. J Med Virol. 1986;19:241–247. - PubMed
Publication types
MeSH terms
LinkOut - more resources
Full Text Sources
Research Materials
Miscellaneous

