Buprenorphine transdermal system for opioid therapy in patients with chronic low back pain
- PMID: 20577660
- PMCID: PMC2912613
- DOI: 10.1155/2010/216725
Buprenorphine transdermal system for opioid therapy in patients with chronic low back pain
Abstract
Objective: The present randomized, double-blinded, crossover study compared the efficacy and safety of a seven-day buprenorphine transdermal system (BTDS) and placebo in patients with low back pain of moderate or greater severity for at least six weeks.
Methods: Prestudy analgesics were discontinued the evening before random assignment to 5 microg/h BTDS or placebo, with acetaminophen 300 mg/codeine 30 mg, one to two tablets every 4 h to 6 h as needed, for rescue analgesia. The dose was titrated to effect weekly, if tolerated, to 10 microg/h and 20 microg/h BTDS. Each treatment phase was four weeks.
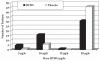
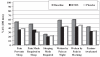
Results: Fifty-three patients (28 men, 25 women, mean [+/- SD] age 54.5+/-12.7 years) were evaluable for efficacy (completed two weeks or more in each phase). Baseline pain was 62.1+/-15.5 mm (100 mm visual analogue scale) and 2.5+/-0.6 (five-point ordinal scale). BTDS resulted in lower mean daily pain scores than in the placebo group (37.6+/-20.7 mm versus 43.6+/-21.2 mm on a visual analogue scale, P=0.0487; and 1.7+/-0.6 versus 2.0+/-0.7 on the ordinal scale, P=0.0358). Most patients titrated to the highest dose of BTDS (59% 20 microg/h, 31% 10 microg/h and 10% 5 microg/h). There were improvements from baseline in pain and disability (Pain Disability Index), Pain and Sleep (visual analogue scale), Quebec Back Pain Disability Scale and Short-Form 36 Health Survey scores for both BTDS and placebo groups, without significant differences between treatments. While there were more opioid-related side effects with BTDS treatment than with placebo, there were no serious adverse events. A total of 82% of patients chose to continue BTDS in a long-term open-label evaluation, in whom improvements in pain intensity, functionality and quality of life were sustained for up to six months without analgesic tolerance.
Conclusion: BTDS (5 microg/h to 20 microg/h) represents a new treatment option for initial opioid therapy in patients with chronic low back pain.
OBJECTIF :: La présente étude randomisée, à double insu, avec permutation des groupes, comparait l’efficacité et l’innocuité d’un système transdermique de buprénorphine (STDB) de sept jours et d’un placebo chez des patients atteints de lombalgie basse d’intensité modérée ou plus, sur une période d’au moins six semaines.
MÉTHODES :: Les analgésiques utilisés avant le début de l’étude ont été cessés la veille de la répartition aléatoire soit à 5 μg/h de STDB ou au placebo, avec acétaminophène 300 mg/codéine 30 mg à raison d’un ou deux comprimés toutes les quatre à six heures au besoin pour analgésie d’appoint. Selon l’effet obtenu, toutes les semaines, il était possible de porter la dose à 10 μg/h et 20 μg/h de STDB, si elle était tolérée. Chaque phase du traitement était d’une durée de quatre semaines.
RÉSULTATS :: Cinquante-trois patients (28 hommes, 25 femmes, âge moyen [± É.-T.] 54,5 ± 12,7 ans) étaient évaluables sur le plan de l’efficacité (c.-à-d., avaient achevé deux semaines ou plus de chaque phase). La douleur au départ se situait à 62,1 ± 15,5 mm (sur une échelle analogique visuelle de 100 mm et à 2,5 ± 0,6 (sur une échelle numérique en cinq points). Le STDB a donné lieu à une baisse plus marquée des indices douloureux quotidiens moyens vs placebo (37,6 ± 20,7 mm vs 43,6 ± 21,2 mm à l’échelle analogique visuelle, p = 0,0487 et 1,7 ± 0,6 vs 2,0 ± 0,7 à l’échelle numérique, p = 0,0358). La dose de STDB de la plupart des patients a été portée au maximum (59 % : 20 μg/h, 31 % : 10 μg/h et 10 % : 5 μg/h). On a noté des améliorations par rapport aux valeurs de départ pour les indices douleur et invalidité (Pain Disability Index), douleur et sommeil (échelle analogique visuelle), l’Échelle d’incapacité du dos du Québec et le questionnaire SF-36 sur la santé, avec le STDB et avec le placebo, sans différence significative entre les traitements. Bien qu’on ait enregistré plus d’effets secondaires des opiacés avec le STDB qu’avec le placebo, aucune réaction indésirable grave n’est survenue. En tout, 82 % des patients ont choisi de continuer le STDB dans le cadre d’une évaluation à long terme ouverte au cours de laquelle les améliorations sur les plans de l’intensité de la douleur, du statut fonctionnel et de la qualité de vie se sont maintenues pendant une période allant jusqu’à six mois, sans épuisement de l’effet analgésique.
CONCLUSION :: Le STDB (de 5 μg/h à 20 μg/h) représente une nouvelle option thérapeutique pour le traitement opiacé initial chez des patients souffrant de lombalgie chronique.
Figures



References
-
- Statistics Canada Back pain<http://www.statcan.gc.ca/pub/82-619-m/2006003/4053542-eng.htm> (Accessed on December 9, 2008).
-
- Toward Optimized Practice Management of low back pain<http://www.topalbertadoctors.org/cpgs/back_pain.html> (Accessed on November 20, 2009).
-
- van Tulder MW, Scholten RJ, Koes BW, Deyo RA. Nonsteroidal anti-inflammatory drugs for low back pain: A systematic review within the framework of the Cochrane Collaboration Back Review Group. Spine. 2000;25:2501–13. - PubMed
Publication types
MeSH terms
Substances
LinkOut - more resources
Full Text Sources

