[What is new in 2010 for electron microscopy in surgical pathology?]
- PMID: 20837234
- PMCID: PMC7115376
- DOI: 10.1016/j.annpat.2010.05.012
[What is new in 2010 for electron microscopy in surgical pathology?]
Abstract
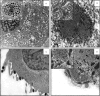
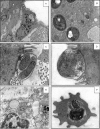
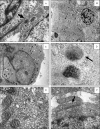
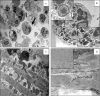
In the last decades, several ancillary methods, such as immunohistochemistry and molecular biology techniques, have increased the possibilities for the diagnosis and to evaluate the prognosis of lesions observed in a laboratory of pathology. Conversely, the impact of another method largely used a couple of years ago in a laboratory of pathology, the electron microscopy (EM), is currently limited. EM is a difficult, quite expensive and long method, which requires technicians with a high qualification. Therefore, EM is currently rarely available at the hospital in a laboratory of pathology and is essentially established in research centers. However, EM is still an essential tool for the surgical pathologist. This method allows in some circumstances to confirm or, more rarely, to make the diagnosis of a couple of tissular and cellular lesions observed in human pathology. EM is also an interesting method to better understand the etiopathogenesis of emerging human diseases, in particular of emerging infectious diseases. In this review, we report the main indication of EM in human pathology, we lay special emphasize in certain infectious diseases and neoplasia.
Différentes méthodes complémentaires permettant d’optimiser le diagnostic et le pronostic des lésions observées dans un laboratoire d’anatomopathologie ont permis, ces dernières années, d’améliorer considérablement l’offre de soins aux patients. Ces méthodes correspondent essentiellement aux techniques d’immuno-histochimie et de biologie moléculaire. La place d’une autre technique autrefois largement utilisée en anatomopathologie, la microscopie électronique (ME), est à l’inverse de plus en plus restreinte. La ME est une méthode longue, difficile, onéreuse, nécessitant un personnel hautement qualifié. Elle est de moins en moins implantée dans un laboratoire de pathologie et devient surtout réservée à des centres universitaires et de recherche. Toutefois, la ME reste un outil indispensable pour le pathologiste. En effet, elle permet parfois de confirmer, et plus exceptionnellement de poser, le diagnostic de certaines lésions tissulaires et cellulaires observées en pathologie humaine. La ME est aussi d’un apport très important pour la compréhension de la physiopathologie de certaines maladies humaines émergentes, notamment d’origine infectieuse. Nous abordons dans cette revue les principales indications actuelles de la ME, en insistant sur certains domaines de la pathologie humaine, comme les maladies infectieuses et certaines tumeurs.
Copyright 2010 Elsevier Masson SAS. All rights reserved.
Figures


References
-
- Erlandson R.A., Rosai J. A realistic approach to the use of electron microscopy and other ancillary diagnostic techniques in surgical pathology. Am J Surg Pathol. 1995;19:247–250. - PubMed
-
- Battaglione-Hofman V., Fischer F., Michiels J.F., Rossi B., Hofman P.M. Ultrastructure of the polymorphonuclear leucocytes in human immunodeficiency virus infection. Pathology. 2000;32:119–125. - PubMed
-
- Liebersli P.P. The tubulovesicular structures – the ultrastructual hallmark for all prion diseases. Acta Neurobiol Exp. 2008;68:113–121. - PubMed
Publication types
MeSH terms
LinkOut - more resources
Full Text Sources

