HPV - A different view on Head and Neck Cancer
- PMID: 29905354
- PMCID: PMC6540966
- DOI: 10.1055/s-0043-121596
HPV - A different view on Head and Neck Cancer
Abstract
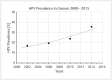
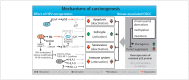
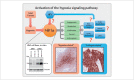
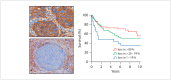
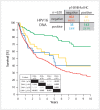
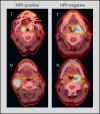
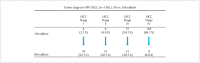
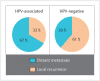
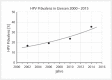
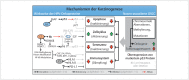
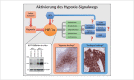
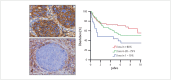
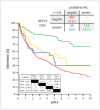
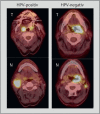
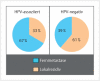
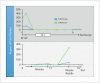
Head and neck cancer is the sixth most common cancer with over 500000 annually reported incident cases worldwide. Besides major risk factors tobacco and alcohol, oropharyngeal squamous cell carcinomas (OSCC) show increased association with human papillomavirus (HPV). HPV-associated and HPV-negative OSCC are 2 different entities regarding biological characteristics, therapeutic response, and patient prognosis. In HPV OSCC, viral oncoprotein activity, as well as genetic (mutations and chromosomal aberrations) and epigenetic alterations plays a key role during carcinogenesis. Based on improved treatment response, the introduction of therapy de-intensification and targeted therapy is discussed for patients with HPV OSCC. A promising targeted therapy concept is immunotherapy. The use of checkpoint inhibitors (e.g. anti-PD1) is currently investigated. By means of liquid biopsies, biomarkers such as viral DNA or tumor mutations in the will soon be available for disease monitoring, as well as detection of treatment failure. By now, primary prophylaxis of HPV OSCC can be achieved by vaccination of girls and boys.
Kopf-Hals-Tumore sind die sechst-häufigste Krebsart mit über 500000 jährlich gemeldeten Fällen weltweit. Die Hauptrisikofaktoren sind Tabak- und Alkoholkonsum, wobei v. a. Oropharynxkarzinome (OSCC) vermehrt eine Assoziation mit humanen Papillomaviren (HPV) aufweisen. Bei HPV-assoziierten und HPV-negativen OSCC handelt es sich bezüglich biologischer Charakteristika, Therapieansprechen und Prognose der Patienten um 2 eigenständige Entitäten, die allerdings bisher identisch behandelt werden. Bei HPV OSCC spielen neben der Aktivität viraler Onkoproteine auch genetische (Mutationen und chromosomale Aberrationen) und epigenetische Veränderungen eine entscheidende Rolle bei der Krebsentstehung. Aufgrund des besseren Therapieansprechens wird aktuell über die Einführung einer De-Intensivierung der Therapie und über zielgerichtete Therapieoptionen für Patienten mit HPV OSCC diskutiert. Ein vielversprechendes zielgerichtetes Therapiekonzept ist bspw. die Immuntherapie. Besonders intensiv wird derzeit die Anwendung von Checkpoint-Inhibitoren (z. B. gegen PD1) erforscht. Mithilfe sogenannter Flüssigbiopsien sollen zukünftig weitere Biomarker, in Form von viraler DNA oder Tumor-Mutationen, zur Überwachung des Krankheitsverlaufs und frühzeitigen Erkennens von Therapieversagen eingesetzt werden. Zur primären Prophylaxe einer Tumorentstehung ist die HPV-Impfung von männlichen und weiblichen Jugendlichen empfehlenswert.
Eigentümer und Copyright ©Georg Thieme Verlag KG 2018.
Conflict of interest statement
Die Autoren geben an, dass kein Interessenkonflikt besteht.
Figures







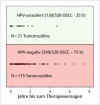
References
-
- Javadi P et al.Evolving disparities in the epidemiology of oral cavity and oropharyngeal cancers. Cancer Causes Control. 2017;28:635–645. - PubMed
-
- Mifsud M et al.Evolving trends in head and neck cancer epidemiology: Ontario, Canada 1993–2010. Head Neck. 2017;39:1770–1778. - PubMed
-
- Nasman A et al.Incidence of human papillomavirus (HPV) positive tonsillar carcinoma in Stockholm, Sweden: an epidemic of viral-induced carcinoma? Int J Cancer. 2009;125:362–366. - PubMed
-
- Wittekindt C et al.Expression of p16 protein is associated with human papillomavirus status in tonsillar carcinomas and has implications on survival. Adv Otorhinolaryngol. 2005;62:72–80. - PubMed
Publication types
MeSH terms
LinkOut - more resources
Full Text Sources
Other Literature Sources
Medical

