Development of an orthotopic syngeneic murine model of colorectal cancer for use in translational research
- PMID: 30760081
- PMCID: PMC6900214
- DOI: 10.1177/0023677219826165
Development of an orthotopic syngeneic murine model of colorectal cancer for use in translational research
Abstract
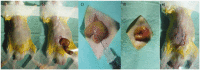
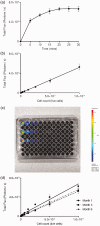
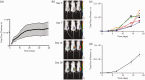
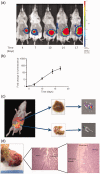
Improving outcomes in colorectal cancer requires more accurate in vivo modelling of the disease in humans, allowing more reliable pre-clinical assessment of potential therapies. Novel imaging techniques are necessary to improve the longitudinal assessment of disease burden in these models, reducing the number of animals required for translational studies. This report describes the development of an immune-competent syngeneic orthotopic murine model of colorectal cancer, utilising caecal implantation of CT26 cells stably transfected with the luciferase gene into immune-competent BALB/c mice, allowing serial bioluminescent imaging of cancer progression. Luminescence in the stably transfected CT26 cell line, after pre-conditioning in the flank of a BALB/c mouse, accurately reflected cell viability and resulted in primary caecal tumours in five of eight (63%) mice in the initial pilot study following caecal injection. Luminescent signal continued to increase throughout the study period with one mouse (20%) developing a liver metastasis. Histopathological assessment confirmed tumours to be consistent with a poorly differentiated adenocarcinoma. We have now performed this technique in 68 immune-competent BALB/c mice. There have been no complications from the procedure or peri-operative deaths, with primary tumours developing in 44 (65%) mice and liver metastases in nine (20%) of these. This technique provides an accurate model of colorectal cancer with tumours developing in the correct microenvironment and metastasising to the liver with a similar frequency to that seen in patients presenting with colorectal cancer, with serial bioluminescent reducing the murine numbers required in studies by removing the need for cull for assessment of disease burden.
L'amélioration des résultats concernant le cancer colorectal (CCR) nécessite une modélisation in vivo plus précise de la maladie chez l'homme, ce qui permet une plus grande fiabilité d'évaluation pré-clinique des thérapies potentielles. De nouvelles techniques d'imagerie sont nécessaires pour améliorer l'évaluation longitudinale du fardeau de la maladie dans ces modèles, afin de réduire le nombre d'animaux requis pour les études translationnelles. Ce rapport décrit le développement d'un modèle murin orthotopique syngénique immuno-compétent de CCR, utilisant l'implantation cæcale de cellules CT26 transfectées de façon stable avec le gène de la luciférase dans les souris BALB/c immuno-compétentes, ce qui permet d'utiliser l'imagerie bioluminescente sérielle pour voir l'évolution du cancer. La luminescence des cellules CT26 transfectées de façon stable, après, pré-conditionnement, dans le flanc d'une souris BALB/c, a clairement reflété la viabilité cellulaire et a donné lieu à des tumeurs cæcales primaires chez 8 des 5 (63%) souris dans l'étude pilote initiale après injection cæcale. Le signal luminescent a continué d'augmenter tout au long de la période d'étude avec une souris (20%) développant des métastases hépatiques. L'évaluation histopathologique a confirmé que les tumeurs étaient compatibles avec un adénocarcinome peu différencié. Nous avons utilisé cette technique chez 68 souris BALB/c immuno-compétentes. Il n'y a pas eu de complications dues à la procédure ni de décès péri-opératoires, avec des tumeurs primaires chez 44 (65%) des souris et des métastases du foie chez neuf (20%) d'entre elles. Cette technique offre un modèle exact du CCR avec les tumeurs se développant dans le microenvironnement correct et se métastasant au niveau du foie avec une fréquence semblable à celle observée chez des patients présentant un cancer colorectal. La bioluminescente sérielle réduit quant à elle le nombre de souris nécessaires dans les études en éliminant la nécessité d'abattage pour évaluer du fardeau de la maladie.
Die Verbesserung der Ergebnisse bei Darmkrebs (CRC) erfordert eine genauere in vivo-Modellierung der Erkrankung beim Menschen, um eine zuverlässigere präklinische Beurteilung potenzieller Therapien zu ermöglichen. Es sind neuartige bildgebende Verfahren notwendig, um die longitudinale Bewertung der Krankheitslast in diesen Modellen zu verbessern und die Anzahl der für translationale Studien benötigten Tiere zu reduzieren. Dieser Bericht beschreibt die Entwicklung eines immunkompetenten syngenetischen orthotopen CRC-Mausmodells unter Verwendung der Zäkumimplantation von CT26-Zellen, die stabil mit dem Luciferase-Gen in immunkompetente BALB/c-Mäuse transfiziert wurden, um eine serielle biolumineszente Darstellung des Krebsverlaufs zu ermöglichen. Die Lumineszenz in der stabil transfizierten CT26-Zelllinie spiegelte nach der Vorkonditionierung in der Flanke einer BALB/c-Maus die Zelllebensfähigkeit exakt wider und führte in der ersten Pilotstudie nach der Zäkuminjektion bei 5 von 8 (63%) Mäusen zu primären Zäkumtumoren. Das Leuchtsignal nahm während des gesamten Untersuchungszeitraums weiter zu, wobei eine Maus (20%) eine Lebermetastase entwickelte. Die histopathologische Beurteilung bestätigte, dass die Tumore mit einem schlecht differenzierten Adenokarzinom übereinstimmen. Wir haben diese Technik nun bei 68 immunkompetenten BALB/c-Mäusen durchgeführt. Es gab weder Komplikationen durch das Verfahren noch perioperative Todesfälle, wobei sich bei 44 (65%) Mäusen Primärtumore und bei neun (20%) von diesen Lebermetastasen entwickelten. Diese Technik bietet ein genaues CRC-Modell mit Tumoren, die sich in der richtigen Mikroumgebung entwickeln und in der Leber mit einer ähnlichen Häufigkeit metastasieren wie bei Patienten mit CRC, wobei die serielle Biolumineszenz die für Studien benötigte Zahl von Mäusen reduziert, da die Notwendigkeit der Tötung zur Beurteilung der Krankheitslast entfällt.
Mejorar los resultados para el cáncer colorrectal requiere una creación más precisa en vivo de modelos de la enfermedad en humanos, lo que permitiría una valoración preclínica más fiable para posibles terapias. Son necesarias nuevas técnicas de creación de imágenes para mejorar la evaluación longitudinal de la carga de la enfermedad en estos modelos, reduciendo el número de animales requeridos para estudios translacionales. Este informe describe el desarrollo de un modelo de murino singenéico ortotópico inmuno competente con un cáncer colorrectal, utilizando la implantación cecal de células CT26 transfectadas establemente con el gen luciferasa en ratones BABB/c inmuno competentes, permitiendo unas imágenes biuluminescentes en serie del avance del cáncer. La luminiscencia en la línea de células CT26 transfectadas, después de un preacondicionamiento en el blanco de un ratón BALB/c, reflejó de forma precisa la viabilidad de las células y provocó tumores cecales primarios en 5 de 8 (63%) de los ratones en el estudio piloto inicial después de una inyección cecal. La señal luminiscente continuó aumentando durante el periodo de estudio con un ratón (20%) desarrollando una metástasis hepática. La evaluación histopatológica confirmó que había tumores consistentes con un adenocarcinoma indebidamente diferenciado. Ahora hemos realizado esta técnica con 68 ratones BALB/c inmuno competentes. No ha habido ninguna compliación con el procedimiento o las muertes perioperativas, con un desarrollo principal de tumores en 44 (65%) de ratones y metástasis hepáticas en nueve (20%) de estos. Esta técnica aporta un modelo preciso de cáncer colorrectar con tumores desarrollándose en el microambinte adecuado y con metástasis hepática con una frecuencia similar a la que se ve en pacientes con cáncer colorrectal, con una bioluminiscencia serial que reduce los números de murinos requeridos en los estudios para eliminar la necesidad de sacrificar demasiados ejemplares para la realización de estudios.
Keywords: bioluminescent imaging; colorectal cancer; orthotopic syngeneic model.
Figures
Similar articles
-
Development and characterization of a reliable mouse model of colorectal cancer metastasis to the liver.Clin Exp Metastasis. 2013 Oct;30(7):903-18. doi: 10.1007/s10585-013-9591-8. Epub 2013 Jun 9. Clin Exp Metastasis. 2013. PMID: 23748471 Free PMC article.
-
An Optimal Orthotopic Mouse Model for Human Colorectal Cancer Primary Tumor Growth and Spontaneous Metastasis.Dis Colon Rectum. 2018 Jun;61(6):698-705. doi: 10.1097/DCR.0000000000001096. Dis Colon Rectum. 2018. PMID: 29722728
-
Suppression of colorectal cancer liver metastasis and extension of survival by expression of apolipoprotein(a) kringles.Cancer Res. 2004 Oct 1;64(19):7092-8. doi: 10.1158/0008-5472.CAN-04-0364. Cancer Res. 2004. PMID: 15466205
-
From mice to men: Murine models of colorectal cancer for use in translational research.Crit Rev Oncol Hematol. 2016 Feb;98:94-105. doi: 10.1016/j.critrevonc.2015.10.009. Epub 2015 Nov 1. Crit Rev Oncol Hematol. 2016. PMID: 26558688 Review.
-
A Decade of Experience in Developing Preclinical Models of Advanced- or Early-Stage Spontaneous Metastasis to Study Antiangiogenic Drugs, Metronomic Chemotherapy, and the Tumor Microenvironment.Cancer J. 2015 Jul-Aug;21(4):274-83. doi: 10.1097/PPO.0000000000000134. Cancer J. 2015. PMID: 26222079 Review.
Cited by
-
Organoids and metastatic orthotopic mouse model for mismatch repair-deficient colorectal cancer.Front Oncol. 2023 Sep 8;13:1223915. doi: 10.3389/fonc.2023.1223915. eCollection 2023. Front Oncol. 2023. PMID: 37746286 Free PMC article.
-
Orthotopic and metastatic tumour models in preclinical cancer research.Pharmacol Ther. 2024 May;257:108631. doi: 10.1016/j.pharmthera.2024.108631. Epub 2024 Mar 11. Pharmacol Ther. 2024. PMID: 38467308 Free PMC article. Review.
-
Effect of MisMatch repair deficiency on metastasis occurrence in a syngeneic mouse model.Neoplasia. 2025 Apr;62:101145. doi: 10.1016/j.neo.2025.101145. Epub 2025 Feb 21. Neoplasia. 2025. PMID: 39985912 Free PMC article.
-
Tumor innervation is triggered by endoplasmic reticulum stress.Oncogene. 2022 Jan;41(4):586-599. doi: 10.1038/s41388-021-02108-6. Epub 2021 Nov 16. Oncogene. 2022. PMID: 34785777
-
Model systems to study tumor-microbiome interactions in early-onset colorectal cancer.EMBO Mol Med. 2025 Mar;17(3):395-413. doi: 10.1038/s44321-025-00198-3. Epub 2025 Feb 13. EMBO Mol Med. 2025. PMID: 39948421 Free PMC article. Review.
References
-
- Evans JP, Sutton PA, Winiarski BK, et al. From mice to men: Murine models of colorectal cancer for use in translational research. Critical Rev Oncol/Hematol 2016; 98: 94–105. - PubMed
-
- Ballou B, Ernst LA, Waggoner AS. Fluorescence imaging of tumors in vivo. Current Medicinal Chem 2005; 12: 795–805. - PubMed
-
- Edinger M, Cao YA, Hornig YS, et al. Advancing animal models of neoplasia through in vivo bioluminescence imaging. Eur J Cancer (Oxford, England: 1990) 2002; 38: 2128–2136. - PubMed
-
- Griswold DP, Corbett TH. A colon tumor model for anticancer agent evaluation. Cancer 1975; 36: 2441–2444. - PubMed
MeSH terms
Grants and funding
LinkOut - more resources
Full Text Sources
Medical

