Dexmedetomidine Preconditioning Reduces Myocardial Ischemia-Reperfusion Injury in Rats by Inhibiting the PERK Pathway
- PMID: 34644786
- PMCID: PMC8757152
- DOI: 10.36660/abc.20200672
Dexmedetomidine Preconditioning Reduces Myocardial Ischemia-Reperfusion Injury in Rats by Inhibiting the PERK Pathway
Abstract
Background: Ischemic heart disease has attracted much attention due to its high mortality rates, treatment costs and the increasing morbidity in the young population. Strategies for reperfusion have reduced mortality. However, reperfusion can lead to cardiomyocyte death and subsequent irreversible myocardial damage. At present, the timely and targeted treatment of ischemia-reperfusion (I/R) injury is often lacking.
Objectives: To evaluate if dexmedetomidine (DEX) has a protective effect in myocardiual I/R and explore the possible mechanism behind it.
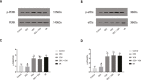
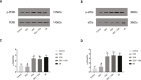
Methods: Rat hearts were perfused with a Langendorff perfusion system, and randomly assigned to five groups: control group, perfused with Krebs-Henseleit (K-H) solution for 205 minutes without ischemia; and four test groups that underwent 40 minutes of global ischemia and 120 min of reperfusion. The DEX group, the yohimbine (YOH) group and the DEX + YOH group were perfused with DEX (10 nM), YOH (1 μM) or the combination of DEX and YOH prior to reperfusion, respectively. Cardiac hemodynamics, myocardial infarct size, and myocardial histology were evaluated. The expression of glucose-related protein 78 (GRP78), protein kinase R-like ER kinase (PERK), phosphorylated PERK, eukaryotic initiation factor 2α (eIF2α), phosphorylated eIF2α, activating transcription factor 4 (ATF4), and CCAAT/enhancer-binding protein homologous protein (CHOP) were assessed. P<0.05 was considered to indicate a statistically significant difference.
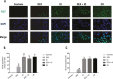
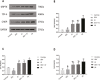
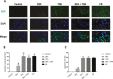
Results: DEX preconditioning improved the cardiac function of I/R hearts, reduced myocardial infarction, myocardial apoptosis, and the expression of GRP78, p-PERK, eIF2α, p-eIF2α, ATF4 and CHOP.
Conclusions: DEX pretreatment reduced myocardial I/R injury by suppressing apoptosis, which was induced by the PERK pathway.
Fundamento: A cardiopatia isquêmica atraiu muito atenção devido às altas taxas de mortalidade, custos do tratamento e a crescente morbidade na população jovem. Estratégias de reperfusão reduziram a mortalidade. Porém, a reperfusão pode levar à morte do cardiomiócito e subsequente dano irreversível ao miocárdio. No momento, não há um tratamento eficiente e direcionado para a lesão de isquemia-reperfusão (I/R).
Objetivos: Avaliar se a dexmedetomidina (DEX) tem efeito protetivo na I/R do miocárdio e explorar os possíveis mecanismos por trás dela.
Métodos: Corações de ratos foram perfundidos com o sistema de perfusão de Langendorff e aleatoriamente distribuídos em cinco grupos: grupo controle, perfundido com solução de Krebs-Henseleit (K-H) por 205 minutos sem isquemia; e quatro grupos de teste que foram submetidos a 40 minutos de isquemia global e 120 minutos de reperfusão. O Grupo DEX, o grupo ioimbina (IO) e o grupo DEX + IO foram perfundidos com DEX (10 nM), IO (1 μM) ou a combinação de DEX e IO antes da reperfusão, respectivamente. A hemodinâmica cardíaca, o tamanho do infarto do miocárdio e a histologia do miocárdio foram avaliados. A expressão da proteína-78 regulada pela glicose (GRP78), a proteína quinase do retículo endoplasmático (PERK), a PERK fosforilada, o fator de iniciação eucariótico 2α (eIF2α), eIF2α fosforilado, o fator de transcrição 4 (TCF-4) e a proteína homóloga à proteína ligadora do acentuador CCAAT (CHOP) foram avaliados. P< 0,05 foi considerado para indicar a diferença estatisticamente significativa.
Resultados: O pré-condicionamento com DEX melhorou a função cardíaca nos corações com I/R, reduziu o infarto do miocárdio, a apoptose do miocárdio e a expressão de GRP78, p-PERK, eIF2α, p-eIF2α, TCF-4 e CHOP.
Conclusões: O pré-tratamento com DEX reduziu a lesão de I/R no miocárdio ao suprimir a apoptose, o que foi induzido pela via PERK.
Conflict of interest statement
Potencial conflito de interesse
Não há conflito com o presente artigo
Figures







Comment in
-
Preconditioning in Ischemia-Reperfusion Lesion.Arq Bras Cardiol. 2021 Dec;117(6):1145-1146. doi: 10.36660/abc.20210908. Arq Bras Cardiol. 2021. PMID: 35613171 Free PMC article. English, Portuguese. No abstract available.
References
-
- Yellon DM, Hausenloy DJ. Myocardial reperfusion injury. N Engl J Med. 2007; 357 (11):1121-35. - PubMed
-
- Ibanez B, Heusch G, Ovize M, Van de Werf F. Evolving therapies for myocardial ischemia/reperfusion injury. J Am Coll Cardiol. 2015; 65 (14):1454-71. - PubMed
-
- Vinten-Johansen J. Involvement of neutrophils in the pathogenesis of lethal myocardial reperfusion injury. Cardiovascular research. 2004; 61 (3):481-97. - PubMed
MeSH terms
Substances
LinkOut - more resources
Full Text Sources
Medical
Research Materials
Miscellaneous

