Joint Guideline on Venous Thromboembolism - 2022
- PMID: 35508060
- PMCID: PMC9007000
- DOI: 10.36660/abc.20220213
Joint Guideline on Venous Thromboembolism - 2022
Erratum in
-
April 2022 Issue, vol. 118(42), pages 797-857.Arq Bras Cardiol. 2022 Jun 10;118(6):1153. doi: 10.36660/abc.20220372. Arq Bras Cardiol. 2022. PMID: 35703660 Free PMC article. English, Portuguese.
Figures
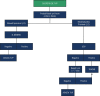
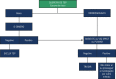
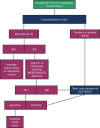
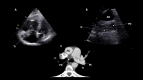





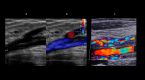
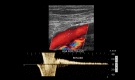
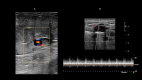
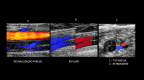
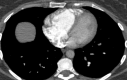
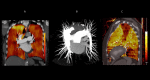
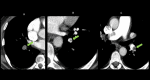
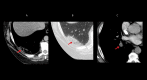
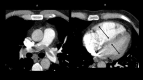
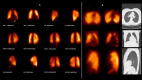
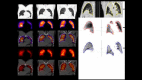
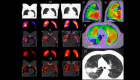
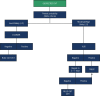
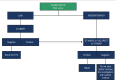
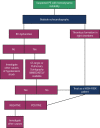
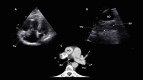


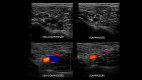
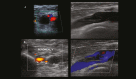
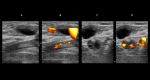
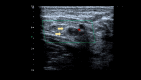
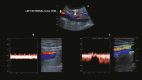

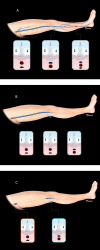
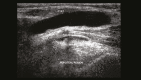

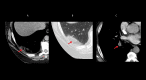
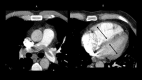
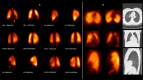

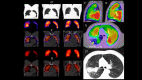
References
-
- Cushman M , Tsai AW , White RH et al . Deep vein thrombosis and pulmonary embolism in two cohorts: the longitudinal investigation of thromboembolism etiology . Am J Med . 2004 ; 117 ( 1 ): 19 - 25 . - PubMed
- Cushman M, Tsai AW, White RH, et al. Deep vein thrombosis and pulmonary embolism in two cohorts: the longitudinal investigation of thromboembolism etiology. Am J Med . 2004;117(1):19–25. - PubMed
-
- Brasil . Ministério da Saúde , 23 jun . 2021 . Datasus . Disponível em: http://tabnet.datasus.gov.br/cgi/tabcgi.exe?sim/cnv/obt10uf.def . Acesso em: 11 de setembro de 2021 .
- Brasil Ministério da Saúde. [Acesso em: 11 de setembro de 2021]; Datasus . 2021 Jun 23; http://tabnet.datasus.gov.br/cgi/tabcgi.exe?sim/cnv/obt10uf.def .
-
- Mazzolai L , Aboyans V , Ageno W et al . Diagnosis and management of acute deep vein thrombosis: a joint consensus document from the European Society of Cardiology working groups of aorta and peripheral vascular diseases and pulmonary circulation and right ventricular function . Eur Heart J . 2018 ; 39 ( 47 ): 4.208 - 18 . - PubMed
- Mazzolai L, Aboyans V, Ageno W, et al. Diagnosis and management of acute deep vein thrombosis: a joint consensus document from the European Society of Cardiology working groups of aorta and peripheral vascular diseases and pulmonary circulation and right ventricular function. Eur Heart J . 2018;39(47):4.208–4.218. - PubMed
MeSH terms
Substances
LinkOut - more resources
Full Text Sources

