Stability of vancomycin hydrochloride employed in antimicrobial seal solutions of central intravenous catheters
- PMID: 35920542
- PMCID: PMC9342908
- DOI: 10.1590/1518-8345.5869.3620
Stability of vancomycin hydrochloride employed in antimicrobial seal solutions of central intravenous catheters
Abstract
Objective: to verify the stability of vancomycin hydrochloride in antimicrobial seal solutions with and without association of heparin sodium according to temperature and association time.
Method: an experimental study designed for the analysis of hydrogenionic potential and concentration by means of high-efficiency liquid chromatography of vancomycin hydrochloride (n=06) and vancomycin hydrochloride and heparin sodium (n=06). The solutions studied were submitted to absence of light, as well as to 22°C and 37°C. Analyses in triplicate (n=192) were performed at the initial moment (T0) and three (T3), eight (T8) and 24 hours (T24) after preparation. The data were submitted to analysis of variance (p≤0.05).
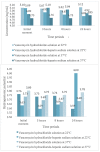
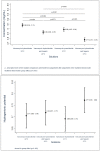
Results: concentration of the antimicrobial at 22°C presented a reduction (T0-T8) and a subsequent increase (T24); hydrogenionic potential decreased significantly over time. At 37°C, the concentration increased up to T3 and decreased at T24, with a reduction of hydrogenionic potential up to 24 hours. Concentration of the vancomycin hydrochloride and heparin sodium solutions varied with a reduction at 22°C, accompanied by increased hydrogenionic potential. Precipitate formation was observed by visual inspection of the vancomycin hydrochloride-heparin sodium association (T3).
Conclusion: pharmacological stability of vancomycin hydrochloride (5 mg/mL) and physical incompatibility with heparin sodium (100 IU/mL) were evidenced after three hours of association in the antimicrobial seal solutions studied.
Objetivo: verificar a estabilidade do cloridrato de vancomicina em soluções de selo antimicrobiano sem e com associação de heparina sódica segundo a temperatura e tempo de associação.
Método: estudo experimental delineado para análise de potencial hidrogeniônico e concentração por cromatografia líquida de alta eficiência de soluções de cloridrato de vancomicina (n=06) e cloridrato de vancomicina e heparina sódica (n=06). Submeteram-se as soluções estudadas à ausência de luz, 22°C e 37°C. Análises em triplicadas (n=192) ocorreram no momento inicial (T0), três (T3), oito (T8) e 24 horas (T24) após preparo. Os dados foram submetidos à análise de variância (p≤0,05).
Resultados: a concentração do antimicrobiano a 22°C apresentou redução (T0-T8) e posterior elevação (T24); o potencial hidrogeniônico diminuiu significativamente ao longo do tempo. Em 37°C a concentração aumentou em até T3 e reduziu em T24, com redução de potencial hidrogeniônico até 24 horas. A concentração das soluções de cloridrato de vancomicina e heparina sódica apresentaram variação com redução a 22°C acompanhada de aumento de potencial hidrogeniônico. Observou-se formação de precipitado por inspeção visual da associação cloridrato de vancomicina e heparina sódica (T3).
Conclusão: evidenciou-se estabilidade farmacológica do cloridrato de vancomicina (5 mg/mL) e incompatibilidade física com heparina sódica (100 UI/mL) após três horas de associação nas soluções de selo antimicrobiano estudadas.
Objetivo: verificar la estabilidad del clorhidrato de vancomicina en soluciones de sellado antimicrobiano solo y combinado con heparina sódica según la temperatura y el tiempo de combinación.
Método: estudio experimental diseñado para analizar el potencial de hidrógeno y la concentración por cromatografía líquida de alta resolución de soluciones de clorhidrato de vancomicina (n=06) y de clorhidrato de vancomicina y heparina sódica (n=06). Las soluciones estudiadas fueron sometidas a ausencia de luz, 22°C y 37°C. Se realizaron análisis por triplicado (n=192) en el momento inicial (T0), a las tres (T3), ocho (T8) y 24 horas (T24) después de la preparación. Los datos fueron sometidos a análisis de varianza (p≤0,05).
Resultados: la concentración de antimicrobiano a 22°C mostró una reducción (T0-T8) y un posterior aumento (T24); el potencial de hidrógeno disminuyó significativamente con el tiempo. A 37°C, la concentración aumentó hasta T3 y disminuyó en T24, el potencial de hidrógeno disminuyó hasta las 24 horas. La concentración de las soluciones de clorhidrato de vancomicina y heparina sódica mostró variación con la reducción a 22°C acompañada de un aumento del potencial de hidrógeno. Mediante inspección visual se observó la formación de un precipitado al combinar clorhidrato de vancomicina y heparina sódica (T3).
Conclusión: el clorhidrato de vancomicina (5 mg/ml) presentó evidencia de estabilidad farmacológica e incompatibilidad física con la heparina sódica (100 UI/ml) después de las tres horas de haberse realizado la combinación en las soluciones de sellado antimicrobiano estudiadas.
Objetivo:: verificar a estabilidade do cloridrato de vancomicina em soluções de selo antimicrobiano sem e com associação de heparina sódica segundo a temperatura e tempo de associação.
Método:: estudo experimental delineado para análise de potencial hidrogeniônico e concentração por cromatografia líquida de alta eficiência de soluções de cloridrato de vancomicina (n=06) e cloridrato de vancomicina e heparina sódica (n=06). Submeteram-se as soluções estudadas à ausência de luz, 22°C e 37°C. Análises em triplicadas (n=192) ocorreram no momento inicial (T0), três (T3), oito (T8) e 24 horas (T24) após preparo. Os dados foram submetidos à análise de variância (p≤0,05).
Resultados:: a concentração do antimicrobiano a 22°C apresentou redução (T0-T8) e posterior elevação (T24); o potencial hidrogeniônico diminuiu significativamente ao longo do tempo. Em 37°C a concentração aumentou em até T3 e reduziu em T24, com redução de potencial hidrogeniônico até 24 horas. A concentração das soluções de cloridrato de vancomicina e heparina sódica apresentaram variação com redução a 22°C acompanhada de aumento de potencial hidrogeniônico. Observou-se formação de precipitado por inspeção visual da associação cloridrato de vancomicina e heparina sódica (T3).
Conclusão:: evidenciou-se estabilidade farmacológica do cloridrato de vancomicina (5 mg/mL) e incompatibilidade física com heparina sódica (100 UI/mL) após três horas de associação nas soluções de selo antimicrobiano estudadas.
Objetivo:: verificar la estabilidad del clorhidrato de vancomicina en soluciones de sellado antimicrobiano solo y combinado con heparina sódica según la temperatura y el tiempo de combinación.
Método:: estudio experimental diseñado para analizar el potencial de hidrógeno y la concentración por cromatografía líquida de alta resolución de soluciones de clorhidrato de vancomicina (n=06) y de clorhidrato de vancomicina y heparina sódica (n=06). Las soluciones estudiadas fueron sometidas a ausencia de luz, 22°C y 37°C. Se realizaron análisis por triplicado (n=192) en el momento inicial (T0), a las tres (T3), ocho (T8) y 24 horas (T24) después de la preparación. Los datos fueron sometidos a análisis de varianza (p≤0,05).
Resultados:: la concentración de antimicrobiano a 22°C mostró una reducción (T0-T8) y un posterior aumento (T24); el potencial de hidrógeno disminuyó significativamente con el tiempo. A 37°C, la concentración aumentó hasta T3 y disminuyó en T24, el potencial de hidrógeno disminuyó hasta las 24 horas. La concentración de las soluciones de clorhidrato de vancomicina y heparina sódica mostró variación con la reducción a 22°C acompañada de un aumento del potencial de hidrógeno. Mediante inspección visual se observó la formación de un precipitado al combinar clorhidrato de vancomicina y heparina sódica (T3).
Conclusión:: el clorhidrato de vancomicina (5 mg/ml) presentó evidencia de estabilidad farmacológica e incompatibilidad física con la heparina sódica (100 UI/ml) después de las tres horas de haberse realizado la combinación en las soluciones de sellado antimicrobiano estudiadas.
Conflict of interest statement
Figures

Similar articles
-
Compatibility and stability of telavancin and vancomycin in heparin or sodium citrate lock solutions.Am J Health Syst Pharm. 2012 Aug 15;69(16):1405-9. doi: 10.2146/ajhp110256. Am J Health Syst Pharm. 2012. PMID: 22855107
-
Compatibility and stability of aztreonam and vancomycin hydrochloride.Am J Health Syst Pharm. 1995 Nov 15;52(22):2560-4. doi: 10.1093/ajhp/52.22.2560. Am J Health Syst Pharm. 1995. PMID: 8590240
-
Stability of vancomycin in an extemporaneously compounded ophthalmic solution.Am J Health Syst Pharm. 1998 Jul 1;55(13):1386-8. doi: 10.1093/ajhp/55.13.1386. Am J Health Syst Pharm. 1998. PMID: 9659967
-
Antibiotic lock: in vitro stability of vancomycin and four percent sodium citrate stored in dialysis catheters at 37 degrees C.Hemodial Int. 2009 Jul;13(3):322-8. doi: 10.1111/j.1542-4758.2009.00368.x. Epub 2009 May 28. Hemodial Int. 2009. PMID: 19493023
-
Long-term stability of vancomycin hydrochloride in intravenous infusions.J Clin Pharm Ther. 1997 Oct-Dec;22(5-6):353-6. doi: 10.1111/j.1365-2710.1997.tb00018.x. J Clin Pharm Ther. 1997. PMID: 19160720
References
-
- Sandoval LJS, Lima FET, Gurgel SS, Freitas I, Barbosa LP, Almeida PC. Translation and cross-cultural adaptation of the instrument patient safety in pediatric drug administration: spanish version. Esc Anna Nery. 2021;25(4) doi: 10.1590/2177-9465-EAN-2020-0333. - DOI
-
- Manrique-Rodríguez S, Heras-Hidalgo I, Pernia-López MS, Herranz-Alonso A, Pisabarro MCDR, Suárez-Mier MB, et al. Standardization and chemical characterization of intravenous therapy in adult patients: a step further in medication safety. Drugs RD. 2021;21:39–64. doi: 10.1007/s40268-020-00329-w. - DOI - PMC - PubMed
MeSH terms
Substances
LinkOut - more resources
Full Text Sources

