Prognostic significance of telomerase reverse transcriptase promoter gen mutations in high grade meningiomas
- PMID: 36511679
- PMCID: PMC9792127
- DOI: 10.7705/biomedica.6100
Prognostic significance of telomerase reverse transcriptase promoter gen mutations in high grade meningiomas
Abstract
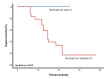
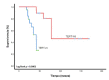
Introduction: Mutations in the promoter region of telomerase reverse transcriptase occur frequently in meningiomas. Objective: To estimate the prognostic importance of telomerase reverse transcriptase mutations in Colombian patients with grades II and III meningioma. Materials and methods: This was a multicenter retrospective cohort study of patients diagnosed with refractory or recurrent WHO grades II and III meningiomas, recruited between 2011 and 2018, and treated with systemic therapy (sunitinib, everolimus ± octreotide, and bevacizumab). Mutation status of the telomerase reverse transcriptase promoter was established by PCR. Results: Forty patients were included, of which telomerase reverse transcriptase mutations were found in 21 (52.5%), being C228T and C250T the most frequent variants with 87.5 % and 14.3 %, respectively. These were more frequent among patients with anaplastic meningiomas (p=0.18), with more than 2 recurrences (p=0.04); and in patients with parasagittal region and anterior fossa lesions (p=0.05). Subjects characterized as having punctual mutations were more frequently administered with everolimus, sunitinib and bevacizumab drug series (p=0.06). Overall survival was 23.7 months (CI95% 13.1-34.2) and 43.4 months (CI95% 37.5-49.3; p=0.0001) between subjects with and without mutations, respectively. Multivariate analysis showed that the number of recurrences and the presence of telomerase reverse transcriptase mutations were tthe only variables that negatively affected overall survival. Conclusions: Mutations in telomerase reverse transcriptase allows the identification of high-risk patients and could be useful in the selection of the best medical treatment.
Introducción. En los meningiomas, ocurren con frecuencia mutaciones en la región promotora de la transcriptasa inversa de la telomerasa. Objetivo. Estimar la importancia pronóstica de las mutaciones de la transcriptasa inversa de la telomerasa en pacientes colombianos con meningiomas de grados II y III. Materiales y métodos. Es un estudio de cohorte, retrospectivo y multicéntrico, que incluyó pacientes con diagnóstico de meningioma persistente o recidivante, de grados II y III, según la clasificación de la OMS, reclutados entre el 2011 y el 2018, con tratamiento sistémico (sunitinib, everolimus con octreótido o sin él, y bevacizumab). El estado de la mutación del promotor de la transcriptasa inversa de la telomerasa se determinó por medio de la PCR. Resultados. Se incluyeron 40 pacientes, en 21 (52,5 %) de los cuales se encontraron mutaciones en la transcriptasa inversa de la telomerasa, siendo las variantes más frecuentes la C228T (87,5 %) y la C250T (14,3 %). Estas fueron más frecuentes entre los pacientes con meningiomas anaplásicos (p=0,18), en aquellos con más de dos recurrencias (p=0,04), y en los que presentaron lesiones en la región parasagital y la fosa anterior (p=0,05). Los sujetos caracterizados por tener alteraciones puntuales fueron tratados con mayor frecuencia con la serie de medicamentos everolimus, sunitinib y bevacizumab (p=0,06). Tras el inicio del tratamiento médico, la supervivencia global fue de 23,7 meses (IC95% 13,1-34,2) en los pacientes con mutaciones y, de 43,4 meses (IC95% 37,5-49,3), entre aquellos sin mutaciones (p=0,0001). Los resultados del análisis multivariado demostraron que, únicamente, el número de recurrencias y la presencia de mutaciones en el gen de la transcriptasa inversa de la telomerasa, fueron factores que afectaron negativamente la supervivencia global. Conclusiones. Las mutaciones en el gen promotor de la transcriptasa inversa de la telomerasa permiten identificar los pacientes con alto riesgo, cuya detección podría ser de utilidad para seleccionar el mejor esquema terapéutico.
Keywords: Meningioma; gain-of-function mutation; telomerase.
Conflict of interest statement
Figures









References
Publication types
MeSH terms
Substances
LinkOut - more resources
Full Text Sources