Stool DNA testing for early detection of colorectal cancer: systematic review using the HTA Core Model® for Rapid Relative Effectiveness Assessment
- PMID: 37426885
- PMCID: PMC10326527
- DOI: 10.3205/000320
Stool DNA testing for early detection of colorectal cancer: systematic review using the HTA Core Model® for Rapid Relative Effectiveness Assessment
Abstract
Background: Stool DNA testing for early detection of colorectal cancer (CRC) is a non-invasive technology with the potential to supplement established CRC screening tests. The aim of this health technology assessment was to evaluate effectiveness and safety of currently CE-marked stool DNA tests, compared to other CRC tests in CRC screening strategies in an asymptomatic screening population.
Methods: The assessment was carried out following the guidelines of the European Network for Health Technology Assessment (EUnetHTA). This included a systematic literature search in MED-LINE, Cochrane and EMBASE in 2018. Manufacturers were asked to provide additional data. Five patient interviews helped assessing potential ethical or social aspects and patients' experiences and preferences. We assessed the risk of bias using QUADAS-2, and the quality of the body of evidence using GRADE.
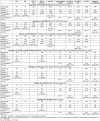
Results: We identified three test accuracy studies, two of which investigated a multitarget stool DNA test (Cologuard®, compared fecal immunochemical test (FIT)) and one a combined DNA stool assay (ColoAlert®, compared to guaiac-based fecal occult blood test (gFOBT), Pyruvate Kinase Isoenzyme Type M2 (M2-PK) and combined gFOBT/M2-PK). We found five published surveys on patient satisfaction. No primary study investigating screening effects on CRC incidence or on overall mortality was found. Both stool DNA tests showed in direct comparison higher sensitivity for the detection of CRC and (advanced) adenoma compared to FIT, or gFOBT, respectively, but had lower specificity. However, these comparative results may depend on the exact type of FIT used. The reported test failure rates were higher for stool DNA testing than for FIT. The certainty of evidence was moderate to high for Cologuard® studies, and low to very low for the ColoAlert® study which refers to a former version of the product and yielded no direct evidence on the test accuracy for ad-vanced versus non-advanced adenoma.
Conclusions: ColoAlert® is the only stool DNA test currently sold in Europe and is available at a lower price than Cologuard®, but reliable evidence is lacking. A screening study including the current product version of ColoAlert® and suitable comparators would, therefore, help evaluate the effectiveness of this screening option in a European context.
Hintergrund: Stuhl-DNA-Tests zur Früherkennung des kolorektalen Karzinoms (KRK) sind nicht-invasiv und können etablierte KRK-Screening-Verfahren ergänzen. Ziel dieses Health Technology Assessment war die Untersuchung der Wirksamkeit und Sicherheit von CE-zertifizierten Stuhl-DNA-Tests im Vergleich zu anderen Tests für ein Screening einer asymptomatischen KRK-Screening-Population.
Methodik: Das Assessment wurde nach den Richtlinien des Europäischen Netzwerks für Health Technology Assessment (EUnetHTA) durchgeführt und schloss eine systematische Literaturrecherche in MEDLINE, Cochrane und EMBASE ein, durchgeführt 2018. Die Hersteller wurden bezüglich der Übermittlung von weiteren Daten kontaktiert. Fünf Patienteninterviews halfen in der Einschätzung möglicher ethischer oder sozialer Aspekte sowie von Patientenerfahrungen und -präferenzen. Wir bewerteten das Verzerrungsrisiko mit QUADAS-2 und verwendeten GRADE, um die Qualität der Evidenz zu bewerten.
Ergebnisse: Wir identifizierten drei Studien zur Testgenauigkeit; zwei untersuchten einen Multitarget-Stuhl-DNA-Test (Cologuard®, im Vergleich zu einem fäkalen immunchemischen Test (FIT)) und eine Studie einen kombinierten DNA-Stuhltest (ColoAlert®, im Vergleich zu einem guajakbasierten Stuhlbluttest (gFOBT), Pyruvate Kinase Isoenzyme Typ M2 (M2-PK) und kombiniertem gFOBT/M2-PK). Wir fanden fünf publizierte Erhebungen zur Patientenzufriedenheit, jedoch keine Primärstudien zu den Auswirkungen eines Screenings mit den beiden Tests auf KRK oder die Gesamtmortalität. Beide Stuhl-DNA-Tests zeigten im direkten Vergleich eine höhere Sensitivität für den Nachweis von KRK und (fortgeschrittenen) Adenomen als FIT beziehungsweise gFOBT, wiesen aber eine geringere Spezifität auf. Diese Ergebnisse könnten jedoch vom genauen Typ des jeweils verwendeten FIT abhängen. Die berichteten Testausfallraten waren beim Stuhl-DNA-Test höher als beim FIT. Die Stärke der Evidenz war moderat bis hoch für die Cologuard®-Studien und niedrig bis sehr niedrig für die ColoAlert®-Studie, die sich auf eine frühere, nicht mehr am Markt befindliche Version des Produkts bezieht und die in den Ergebnissen zur Testgenauigkeit nicht zwischen fortgeschrittenen und nicht-fortgeschrittenen Adenomen differenzierte.
Schlussfolgerungen: ColoAlert® ist der einzige derzeit in Europa am Markt befindliche Stuhl-DNA-Test und ist zu einem niedrigeren Preis als Cologuard® erhältlich, jedoch fehlt zuverlässige Evidenz. Eine Screening-Studie mit Implementierung der aktuellen Produktversion von ColoAlert® und geeigneten Komparatoren würde daher helfen, diese Screening-Option im europäischen Kontext zu evaluieren.
Keywords: colorectal cancer screening; colorectal neoplasms; multitarget stool DNA test; sensitivity; specificity; test performance.
Copyright © 2023 Stürzlinger et al.
Conflict of interest statement
See full report [28] (published on the EunetHTA website), page 3.
Figures





Similar articles
-
Fecal occult blood test for colorectal cancer screening: an evidence-based analysis.Ont Health Technol Assess Ser. 2009;9(10):1-40. Epub 2009 Sep 1. Ont Health Technol Assess Ser. 2009. PMID: 23074514 Free PMC article.
-
Faecal pyruvate kinase isoenzyme type M2 for colorectal cancer screening: a meta-analysis.World J Gastroenterol. 2012 Aug 14;18(30):4004-11. doi: 10.3748/wjg.v18.i30.4004. World J Gastroenterol. 2012. PMID: 22912551 Free PMC article.
-
Stool Based Testing for Colorectal Cancer: an Overview of Available Evidence.Curr Gastroenterol Rep. 2017 Aug;19(8):39. doi: 10.1007/s11894-017-0579-4. Curr Gastroenterol Rep. 2017. PMID: 28730505 Review.
-
Early Detection of Colorectal Cancer: a Multi-Center Pre-Clinical Case Cohort Study for Validation of a Combined DNA Stool Test.Clin Lab. 2018 Oct 1;64(10):1719-1730. doi: 10.7754/Clin.Lab.2018.180521. Clin Lab. 2018. PMID: 30336540
-
Colon cancer screening: which non-invasive filter tests?Dig Dis. 2011;29 Suppl 1:56-9. doi: 10.1159/000331127. Epub 2011 Nov 15. Dig Dis. 2011. PMID: 22104755 Review.
Cited by
-
Diagnostic Accuracy of Multitarget Stool DNA Test for Colorectal Cancer Screening and Detecting in Thailand.Asian Pac J Cancer Prev. 2024 Oct 1;25(10):3661-3665. doi: 10.31557/APJCP.2024.25.10.3661. Asian Pac J Cancer Prev. 2024. PMID: 39471034 Free PMC article.
-
Colorectal Cancer: Epidemiology, Risk Factors, and Prevention.Cancers (Basel). 2024 Apr 17;16(8):1530. doi: 10.3390/cancers16081530. Cancers (Basel). 2024. PMID: 38672612 Free PMC article. Review.
-
Advances in blood DNA methylation-based assay for colorectal cancer early detection: a systematic updated review.Gastroenterol Hepatol Bed Bench. 2024;17(3):225-240. doi: 10.22037/ghfbb.v17i3.2978. Gastroenterol Hepatol Bed Bench. 2024. PMID: 39308542 Free PMC article. Review.
-
Are we properly evaluating genetic and genomic testing? A systematic review of health technology assessment reports.J Transl Med. 2025 Jul 7;23(1):749. doi: 10.1186/s12967-025-06703-z. J Transl Med. 2025. PMID: 40624720 Free PMC article.
-
Screening History and 7-Year Survival in 32,099 Colorectal Cancer Patients: A Population-Based Cohort Study.Clin Epidemiol. 2023 Oct 3;15:1009-1025. doi: 10.2147/CLEP.S424918. eCollection 2023. Clin Epidemiol. 2023. PMID: 37811122 Free PMC article.
References
Publication types
MeSH terms
Substances
LinkOut - more resources
Full Text Sources
Other Literature Sources
Medical

