[Pattern of biochemical markers of mineral and bone disorders in kidney transplant recipients: real-world data]
- PMID: 37448271
- PMCID: PMC10204791
- DOI: 10.14341/probl13167
[Pattern of biochemical markers of mineral and bone disorders in kidney transplant recipients: real-world data]
Abstract
Background: There is a lack of studies providing comprehensive data on the prevalence of mineral and bone disorders (MBD) laboratory abnormalities after kidney transplantation in Russia.
Aim: to obtain real-world data on the prevalence of the main mineral abnormalities among kidney transplant recipients and to revise their concomitant MBD therapy.
Method: This cross-sectional study included 236 patients with successful kidney transplantation. Their serum intact parathyroid hormone (iPTH), total calcium (Ca), phosphorus (P), and alkaline phosphatase (ALP) levels were measured.
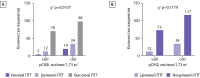
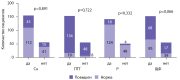
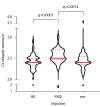
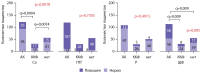
Results: Only 6.2% of our cohort had all laboratory parameters within the target range, whereas persistent HPT along with hypercalcemia was noted in almost one third of the patients (31%). Normal iPTH levels were observed in 13% cases; 84% of the patients had hyperparathyroidism. The fraction of patients with target iPTH did not differ between the groups with normal and decreased estimated glomerular filtration rate (eGFR) (p=0.118). Hypercalcemia was observed in 29% cases. The serum P level varied significantly in groups with different eGFR (p<0.0001), increasing with declining graft function. Furthermore, 40.7% of patients had ALP above the target range. While 123 patients received active vitamin D (alfacalcidol), 33 received monotherapy with inactive vitamin D (cholecalciferol). The control group consisted of 57 medication-naïve patients. The serum total Ca level varied significantly between the groups (p=0.0006), being higher in patients supplemented with cholecalciferol. The fraction of patients with normocalcemia was lowest in the cholecalciferol group (chi-square, р=0.0018).
Conclusion: The prevalence of biochemical abnormalities after kidney transplantation is high. Alfacalcidol usage may be safer than using cholecalciferol to prevent hypercalcemia development.
АКТУАЛЬНОСТЬ: АКТУАЛЬНОСТЬ. На сегодняшний день крайне мало исследований, представляющих объективные данные о распространенности минеральных и костных нарушений (МКН) у реципиентов почечного трансплантата (ПТ) в России. ЦЕЛЬ. Провести скрининг, включающий определение основных лабораторных показателей МКН у пациентов, перенесших аллотрансплантацию трупной почки (АТП), а также оценить назначение сопроводительной терапии, направленной на коррекцию МКН при хронической болезни почек (МКН-ХБП).
МАТЕРИАЛЫ И МЕТОДЫ: МАТЕРИАЛЫ И МЕТОДЫ. В поперечное исследование были включены 236 пациентов, перенесших успешную трансплантацию почки. У всех пациентов определяли уровень интактного паратиреоидного гормона (ПТГ), общего кальция, фосфора, щелочной фосфатазы (ЩФ) сыворотки.
РЕЗУЛЬТАТЫ: РЕЗУЛЬТАТЫ. Лишь у 6,2% реципиентов ПТ наблюдались целевые уровни всех исследуемых лабораторных показателей МКН, при этом повышенный уровень ПТГ в сочетании с гиперкальциемией был отмечен почти у трети пациентов (31%). Целевой уровень ПТГ наблюдался у 13% реципиентов, 84% пациентов демонстрировали гиперпаратиреоз. Доли пациентов с целевым уровнем ПТГ не различались в группах реципиентов с сохранной и сниженной расчетной скоростью клубочковой фильтрации (рСКФ) (p=0,118). Гиперкальциемия наблюдалась у 29% реципиентов. Уровни неорганического фосфора сыворотки значительно различались в группах пациентов с разной рСКФ (p<0,0001), возрастая по мере снижения функции трансплантата. У 40,7% пациентов было отмечено повышение уровня ЩФ. В качестве сопутствующей терапии 123 пациента получали активный витамин D (альфакальцидол), 33 пациента — препарат неактивной формы витамина D (колекальциферол), 57 пациентов не получали лекарственной терапии МКН-ХБП. Уровень общего кальция сыворотки статистически значимо различался в этих группах (p=0,0006), наиболее высокий его уровень отмечался в группе терапии колекальциферолом. Доля пациентов с нормокальциемией в группе лечения колекальциферолом была наиболее низкой (χ2 р=0,0018).
ЗАКЛЮЧЕНИЕ: ЗАКЛЮЧЕНИЕ. Распространенность МКН у реципиентов ПТ очень высока. Применение альфакальцидола по сравнению с препаратами неактивной формы витамина D может быть более безопасным в отношении развития гиперкальциемии.
Figures



References
-
- Andrusev A.M., Tomilina N.A., Peregudova N.G., Shinkarev M.B. Renal replacement therapy for End Stage Renal Disease in Russian Federation, 2014-2018. Russian National Renal Replacement Therapy Registry Report of Russian Public Organization of Nephrologists “Russian Dialysis Society”. 2020. Apr, - DOI
-
- Wolfe Robert A., Ashby Valarie B., Milford Edgar L., Ojo Akinlolu O., Ettenger Robert E., Agodoa Lawrence Y.C., Held Philip J., Port Friedrich K.. Comparison of Mortality in All Patients on Dialysis, Patients on Dialysis Awaiting Transplantation, and Recipients of a First Cadaveric Transplant. New England Journal of Medicine. 2002 Jul;341(23):1725–1730. doi: 10.1056/nejm199912023412303. - DOI - PubMed
Publication types
MeSH terms
Substances
LinkOut - more resources
Full Text Sources
Medical
Research Materials
Miscellaneous
