SYNAPSES. A European observational study to evaluate the safety and the effectiveness of safinamide in routine clinical practice: post-hoc analysis of the Spanish study population
- PMID: 37752685
- PMCID: PMC10831700
- DOI: 10.33588/rn.77s02.2023217
SYNAPSES. A European observational study to evaluate the safety and the effectiveness of safinamide in routine clinical practice: post-hoc analysis of the Spanish study population
Abstract
Introduction: Parkinson's Disease (PD) is a progressive age-related neurodegenerative condition requiring new therapeutic alternatives. Safinamide, a novel levodopa add-on therapy, positively affects disease fluctuations by modulating both dopaminergic and glutamatergic systems. To further investigate the use of safinamide in European routine clinical practice, the present post-hoc analysis aimed to understand safinamide's safety profile within the Spanish study population.
Patients and methods: Five hundred eleven Spanish patients with PD were evaluated at baseline, four (±1), eight (±1), and 12 (±1) months after initiating safinamide treatment. Unified Parkinson's Disease Rating Scale (UPDRS) total score and UPDRS part III score during on time were used to measure the overall severity of PD and motor complications, respectively, while the severity of adverse events was evaluated following the investigators' criteria.
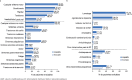
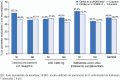
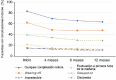
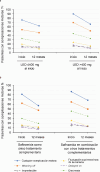
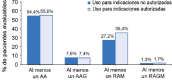
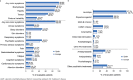
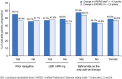
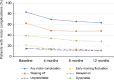
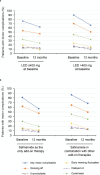
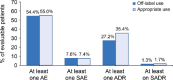
Results: Safinamide showed a favourable safety profile within the Spanish study population, although prescription to patients with psychiatric conditions and off-label use were more frequent than in the European study population. In Spain, clinically meaningful improvements were observed in UPDRS scores when safinamide was used as the only add-on therapy to levodopa (57.4% and 53.7% of patients) and when switching from rasagiline (55.1% of patients). Motor complications were reduced from 83.2% to 63.3% after the study period. Increased safety concerns were undetected in any patient subgroup, although patients with cognitive impairment showed a slightly higher frequency of adverse events.
Conclusions: This subanalysis further supports safinamide use as a safe and efficacious option for the management of motor fluctuations in different subgroups of levodopa-treated patients. However, safinamide should be used with caution in patients with cognitive impairment.
Title: SYNAPSES. Estudio observacional europeo para evaluar la seguridad y la efectividad de la safinamida en la práctica clínica habitual: análisis post hoc de la población española del estudio.
Introducción. La enfermedad de Parkinson (EP) es una enfermedad neurodegenerativa progresiva relacionada con la edad que requiere nuevas alternativas terapéuticas. La safinamida, un nuevo tratamiento add-on a la levodopa, afecta positivamente a las fluctuaciones de esta enfermedad al modular los sistemas dopaminérgico y glutamatérgico. Para investigar más a fondo el uso de la safinamida en la práctica clínica rutinaria europea, el presente análisis post hoc tiene como objetivo comprender el perfil de seguridad de la safinamida dentro de la población española del estudio. Pacientes y métodos. Se evaluó a 511 pacientes españoles con EP al inicio, cuatro (±1), ocho (±1) y 12 (±1) meses después de iniciar el tratamiento con safinamida. Se utilizaron la puntuación total de la escala unificada de puntuación de la enfermedad de Parkinson (UPDRS) y la puntuación de la UPDRS III, durante el tiempo en on para medir la gravedad general de la EP y las complicaciones motoras, respectivamente, mientras que la gravedad de los acontecimientos adversos se evaluó siguiendo los criterios de los investigadores. Resultados. La safinamida mostró un perfil de seguridad favorable en la población española del estudio, aunque la prescripción a pacientes con enfermedades psiquiátricas y el uso para indicaciones no autorizadas fueron más frecuentes que en la población europea del estudio. En España se observaron mejoras clínicamente significativas en las puntuaciones de la UPDRS cuando se utilizó la safinamida como único tratamiento add-on a la levodopa (el 57,4 y el 53,7% de los pacientes) y cuando se venía de administrar rasagilina (el 55,1% de los pacientes). Las complicaciones motoras se redujeron del 83,2 al 63,3% tras el período de estudio. No se detectaron mayores problemas de seguridad en ningún subgrupo de pacientes, aunque los pacientes con deterioro cognitivo mostraron una frecuencia algo superior de acontecimientos adversos. Conclusiones. Este subanálisis respalda el uso de la safinamida como opción segura y eficaz para el tratamiento de las fluctuaciones motoras en diferentes subgrupos de pacientes tratados con levodopa. Sin embargo, la safinamida debe utilizarse con precaución en pacientes con deterioro cognitivo.
Conflict of interest statement
Conflicto de intereses: Durante los últimos tres años, J.K.B. ha recibido honorarios por dar conferencias o formar parte de los consejos asesores de Roche, Zambon, Sanofi, Esteve, SOM Biotech, Lundbeck, Teva, Bial, UCB, General Electric, AbbVie y Kyowa Kirin International. A.E. ha recibido remuneraciones por servicios de consultoría y honorarios por conferencias de Zambon, Esteve, Teva, Bial, UCB y AbbVie. I.L.R. ha recibido honorarios por dar conferencias o formar parte de los consejos asesores de Zambon y AbbVie. M.M.A.S. ha recibido honorarios como conferenciante de Zambon, Bial, AbbVie, Kerka, Stada, Italfármaco y Devonlabs. E.F.A. recibió honorarios por asesoramiento, consultoría y conferencias de AbbVie, Teva, Bial, Zambon, UCB, Esteve y Neuraxpharm, así como financiación de AbbVie, Neuroderm, Cerevel, Roche, Anavex, Bial, Zambon, Impax e Irlab. J.C.G.E. ha recibido honorarios por dar conferencias o formar parte de los consejos asesores de Zambon, UCB y AbbVie.
Figures
References
-
- de Lau LML, Breteler MMB. Epidemiology of Parkinson's disease. Lancet Neurol. 2006;5:525–35. - PubMed
Publication types
MeSH terms
Substances
LinkOut - more resources
Full Text Sources
Medical

