Attenuated effects of topical vinpocetine in an imiquimod-induced mouse model of psoriasis
- PMID: 37868105
- PMCID: PMC10585306
- DOI: 10.1016/j.jtumed.2023.09.002
Attenuated effects of topical vinpocetine in an imiquimod-induced mouse model of psoriasis
Abstract
Psoriasis is an uncontrolled, long-lasting inflammatory dermatosis distinguished by thickened, erythematous, and flaky skin lesions. Massive amounts of inflammatory cytokines are produced when immune system imbalances are driven by genetic and environmental triggers. Vinpocetine (VNP), a man-made analogue of the compound vincamine found in the dwarf periwinkle herb, has robust anti-inflammatory, immunomodulatory, and anti-oxidative effects; alleviates the epidermal penetration of immune cells, such as eosinophils and neutrophils; and abolishes the generation of pro-inflammatory molecules.
Objective: This study was aimed at exploring the effects of long-term topical VNP, both alone and co-administered with clobetasol propionate, in an imiquimod-induced mouse model of psoriasiform dermatitis.
Methods: The study protocol consisted of 48 Swiss albino mice, randomly divided into six groups of eight mice each. In group I, petroleum jelly was administered daily for 8 days. In group II, imiquimod was administered topically at 62.5 mg daily for 8 days. In groups III, VI, V, and VI, 0.05% clobetasol propionate, 1% VNP, 3% VNP, and 3% VNP plus 0.05% clobetasol were administered topically for an additional 8 days after the induction, thus resulting in a total trial length of 16 days.
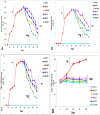
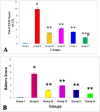
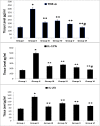
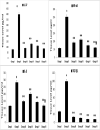
Results: Topical VNP at various doses alleviated the severity of imiquimod-induced psoriatic lesions-including erythema, silvery-white scaling, and thickening-and reversed the histopathological abnormalities. Moreover, imiquimod-exposed animals treated with VNP showed markedly diminished concentrations of inflammatory biomarkers, including tumour necrosis factor-α, interleukin (IL)-8, IL-17A, IL-23, IL-37, nuclear factor-kappa B (NF-κB), and transforming growth factor-β1.
Conclusion: This research provides new evidence that VNP, alone and in combination with clobetasol, may serve as a potential adjuvant for long-term management of autoimmune and autoinflammatory skin diseases, particularly psoriasis, by attenuating psoriatic lesion severity, suppressing cytokine generation, and limiting NF-κB-mediated inflammation.
أهداف البحث: الصدفية هي مرض جلدي التهابي غير منضبط وطويل الأمد يتميز بآفات جلدية سميكة وحمامية ومتقشرة. يتم إنتاج كميات هائلة من السيتوكينات الالتهابية عندما تكون اختلالات الجهاز المناعي مدفوعة بمحفزات وراثية وبيئية. فينبوسيتين، وهو نظير من صنع الإنسان للفينكامين الموجود في عشبة النكة القزمة، هو دواء قوي مضاد للالتهابات، ومعدل للمناعة، ومضاد للأكسدة يمكن أن يخفف من تغلغل الخلايا المناعية، مثل الحمضات والعدلات في البشرة وإلغاء الجيل من العناصر المؤيدة للالتهابات.
طريقة البحث: لاستكشاف التأثير المخفف للفينبوسيتين الموضعي طويل الأمد بمفرده أو مع بروبيونات كلوبيتاسول على نماذج الفئران التي لديها التهاب الجلد الصدفي. يتكون بروتوكول الدراسة من 48 فأرا سويسريا من النوع الأبيض، تم تجميعها عشوائيا في 6 مجموعات تضم كل منها 8 فئران. في المجموعة الأولى، تم إعطاء الفازلين يوميا لمدة ثمانية أيام. في المجموعة الثانية، تم إعطاء إيميكيمود موضعيا بجرعة 62.5 ملغ يوميا لمدة ثمانية أيام. في مجموعات العلاج 3، و 4، و 5، و6 تم إعطاء بروبيونات كلوبيتاسول 0.05٪، فينبوسيتين 1٪، فينبوسيتين 3٪، وفينبوسيتين 3٪ بالإضافة إلى كلوبيتاسول 0.05٪ موضعيا لمدة 8 أيام إضافية بعد التحريض، ليصل إجمالي طول التجربة إلى 16 يوما.
النتائج: خفف الفينبوسيتين الموضعي بجرعات مختلفة من شدة آفات الصدفية الناجمة عن الإيميكيمود، مثل الحمامي، والقشور البيضاء الفضية، والسماكة، وعكس التشوهات المرضية. علاوة على ذلك، فإن الحيوانات المعرضة للإيميكيمود والتي عولجت بالفينبوسيتين قللت بشكل كبير من تركيزات المؤشرات الحيوية الالتهابية، بما في ذلك عامل نخر الورم-ألفا، والإنترلوكين-8، والإنترلوكين-17أ، والإنترلوكين-23، والإنترلوكين-37، والعامل النووي-كابا بي، وتحويل عامل النمو-بيتا1.
الاستنتاجات: يقدم البحث الحالي دليلا جديدا على أن الفينبوسيتين وحده مع كلوبيتاسول هو مادة مساعدة محتملة للإدارة طويلة الأمد لأمراض المناعة الذاتية والالتهابات الجلدية الذاتية، وخاصة الصدفية، عن طريق تخفيف شدة الآفات الصدفية، وقمع توليد السيتوكينات، والحد من العامل النووي-كابا بي.
Keywords: Antipsoriatic therapy; Imiquimod; Immune-mediated dermatoses; Inflammatory skin diseases; Mouse model of psoriasis; Vinpocetine.
© 2023 The Authors.
Figures




Similar articles
-
The alleviative effects of canagliflozin on imiquimod-induced mouse model of psoriasis-like inflammation.Naunyn Schmiedebergs Arch Pharmacol. 2025 Mar;398(3):2695-2715. doi: 10.1007/s00210-024-03406-y. Epub 2024 Sep 10. Naunyn Schmiedebergs Arch Pharmacol. 2025. PMID: 39254877
-
Ameliorative effects of topical ramelteon on imiquimod-induced psoriasiform inflammation in mice.Naunyn Schmiedebergs Arch Pharmacol. 2024 Aug;397(8):6231-6248. doi: 10.1007/s00210-024-03017-7. Epub 2024 Mar 6. Naunyn Schmiedebergs Arch Pharmacol. 2024. PMID: 38446218
-
The ameliorative effects of topical gemifloxacin alone or in combination with clobetasol propionate on imiquimod-induced model of psoriasis in mice.Naunyn Schmiedebergs Arch Pharmacol. 2024 Jan;397(1):599-616. doi: 10.1007/s00210-023-02629-9. Epub 2023 Jul 25. Naunyn Schmiedebergs Arch Pharmacol. 2024. PMID: 37490123
-
Novel effect of topical Roquinimex and its combination with Clobetasol on an imiquimod-induced model of psoriasis in mice.Naunyn Schmiedebergs Arch Pharmacol. 2024 Jul;397(7):5219-5232. doi: 10.1007/s00210-024-02947-6. Epub 2024 Jan 24. Naunyn Schmiedebergs Arch Pharmacol. 2024. PMID: 38265682
-
Evaluation of Clobetasol and Tacrolimus Treatments in an Imiquimod-Induced Psoriasis Rat Model.Int J Mol Sci. 2024 Aug 26;25(17):9254. doi: 10.3390/ijms25179254. Int J Mol Sci. 2024. PMID: 39273201 Free PMC article.
Cited by
-
The alleviative effects of canagliflozin on imiquimod-induced mouse model of psoriasis-like inflammation.Naunyn Schmiedebergs Arch Pharmacol. 2025 Mar;398(3):2695-2715. doi: 10.1007/s00210-024-03406-y. Epub 2024 Sep 10. Naunyn Schmiedebergs Arch Pharmacol. 2025. PMID: 39254877
-
Efficacy and Safety of Apremilast in Oncological Patients with Moderate-to-Severe Plaque Psoriasis: A 5 years Retrospective Observational Study.Clin Cosmet Investig Dermatol. 2025 May 20;18:1231-1238. doi: 10.2147/CCID.S499658. eCollection 2025. Clin Cosmet Investig Dermatol. 2025. PMID: 40416945 Free PMC article.
-
Vildagliptin topical ointment: an effective treatment for imiquimod-induced psoriasis in mice.J Mol Histol. 2025 Apr 26;56(3):143. doi: 10.1007/s10735-025-10416-4. J Mol Histol. 2025. PMID: 40285915
-
The Possible effect of Bosentan on the methotrexate-induced salivary gland changes in male rats: histological and Immunohistochemical study.Toxicol Res (Camb). 2025 Jan 17;14(1):tfaf007. doi: 10.1093/toxres/tfaf007. eCollection 2025 Feb. Toxicol Res (Camb). 2025. PMID: 39830884
-
Ameliorative effects of topical ramelteon on imiquimod-induced psoriasiform inflammation in mice.Naunyn Schmiedebergs Arch Pharmacol. 2024 Aug;397(8):6231-6248. doi: 10.1007/s00210-024-03017-7. Epub 2024 Mar 6. Naunyn Schmiedebergs Arch Pharmacol. 2024. PMID: 38446218
References
LinkOut - more resources
Full Text Sources

