[Endoscopic Resection Techniques for Precancerous and Early Cancerous Lesions in the Rectum]
- PMID: 38442883
- PMCID: PMC10914494
- DOI: 10.1055/a-2256-6724
[Endoscopic Resection Techniques for Precancerous and Early Cancerous Lesions in the Rectum]
Abstract
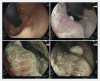
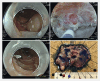
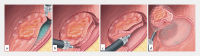
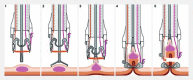
Today, endoscopy plays a decisive role not only in the detection of colorectal adenomas and carcinomas, but also in the treatment of precancerous lesions, in particular flat adenomas and early carcinomas. In recent years, endoscopic submucosal dissection (ESD) has become increasingly important alongside classic polypectomy and mucosal resection after saline injection using a snare (EMR). Using ESD the lesion is marked, injected submucosally using viscous substances and the mucosa incised and tunneled with a transparent cap and a fine diathermy knife. Particularly in the case of widespread and high-risk lesions ESD enables a quasi-surgical "en bloc" resection almost regardless of size, with a histological R0 resection rate of far over 90% in specialized centers. ESD enables an excellent histopathological evaluation and has a low recurrence risk of 1-3%. Endoscopic full-thickness resection using a dedicated device (FTRD system) represents another addition to the armamentarium. It can be used for circumscribed submucosal, suspicious or scarred changes up to 2 cm in the middle and upper rectum. Endoscopic intermuscular dissection (EID) enables histopathological analysis of the complete submucosa beyond the mucosa and upper submucosal layer by including the circular inner muscle layer within the resection specimen. It reduces basal R1 situations and offers a new perspective for T1 carcinomas through curative, organ-preserving endoscopic therapy, especially in the case of deep submucosal infiltration alone, without other risk factors for metastases. Indications, the procedure itself and significance of the various techniques for premalignant and early malignant lesions in the rectum are presented.
Die Endoskopie spielt heute nicht nur in der Erkennung von kolorektalen Adenomen und Karzinomen eine entscheidende Rolle, sondern auch in der Behandlung von insbesondere flächigen Adenomen und frühen Karzinomen. In den letzten Jahren hat neben der klassischen Polypektomie und Mukosaresektion flach-erhabener Läsionen mit der Schlinge (EMR), die endoskopische Submukosadissektion (ESD) einen zunehmenden Stellenwert erlangt. Hierbei erfolgt nach Markierung, Unterspritzung und Inzision der Mukosa um die Läsion, die Untertunnelung und das „En-bloc“-Auslösen durch eine transparente Aufsatzkappe und ein feines Diathermiemesser. Gerade bei flächigen Veränderungen mit hohem Rezidivrisiko einer Piecemeal-Resektion durch EMR sowie bei Risikoläsionen ermöglicht die ESD, nahezu größenunabhängig in der Hand des Erfahrenen, einen sicheren Abtrag mit einer histologischen R0-Resektionsrate an Zentren von weit über 90%. Die ESD ermöglicht eine optimale histopathologische Ausbeute und weist ein niedriges Rezidivrisiko von 1–3% auf. Eine weitere Bereicherung des Armamentariums stellt die endoskopische Vollwandresektion mit einem speziellen Applikationssystem dar (FTRD-System). Dieses eignet sich für umschriebene submuköse, suspekte oder narbige Veränderungen bis 2 cm Größe im mittleren und oberen Rektum. Die endoskopische intermuskuläre Dissektion (EID) ermöglicht durch Mitnahme der zirkulären inneren Muskelschicht bei der Resektion die histopathologische Analyse der kompletten Submukosa über Mukosa und obere Submukosaschicht hinaus. Sie bietet bei T1-Karzinomen ein geringeres Risiko der basalen R1-Situation und eine neue Perspektive durch die kurative, organerhaltende endoskopische Therapie bei alleiniger tiefer Submukosainfiltration ohne weitere Risikofaktoren für eine Metastasierung. Indikationen, Technik und Stellenwert der verschiedenen Techniken bei prämaligen und frühmaligen Läsionen im Rektum werden dargestellt.
The Author(s). This is an open access article published by Thieme under the terms of the Creative Commons Attribution-NonDerivative-NonCommercial-License, permitting copying and reproduction so long as the original work is given appropriate credit. Contents may not be used for commercial purposes, or adapted, remixed, transformed or built upon. (https://creativecommons.org/licenses/by-nc-nd/4.0/).
Conflict of interest statement
Es besteht kein primärer Interessenskonflikt in Bezug auf den Beitrag. Forschungsunterstützung: Erbe, Tübingen: Fujifilm Europe, Ratingen; Medtronic, Meerbusch; Ovesco, Tübingen. Honorare für Vorträge: Falk Foundation, Freiburg; Fujifilm Europe, Ratingen; Ovesco, Tübingen.
Figures



Similar articles
-
Endoscopic Resection Techniques for Widespread Precancerous Lesions and Early Carcinomas in the Rectum.J Clin Med. 2025 May 9;14(10):3322. doi: 10.3390/jcm14103322. J Clin Med. 2025. PMID: 40429318 Free PMC article. Review.
-
AGA Institute Clinical Practice Update: Endoscopic Submucosal Dissection in the United States.Clin Gastroenterol Hepatol. 2019 Jan;17(1):16-25.e1. doi: 10.1016/j.cgh.2018.07.041. Epub 2018 Aug 2. Clin Gastroenterol Hepatol. 2019. PMID: 30077787 Review.
-
[Full thickness resection device (FTRD). Experience and outcome for benign neoplasms of the rectum and colon].Chirurg. 2016 Apr;87(4):316-25. doi: 10.1007/s00104-015-0091-z. Chirurg. 2016. PMID: 26438202 German.
-
Submucosal endoscopy with mucosal resection: a hybrid endoscopic submucosal dissection in the porcine rectum and distal colon.Gastrointest Endosc. 2012 Oct;76(4):829-34. doi: 10.1016/j.gie.2012.05.037. Epub 2012 Jul 31. Gastrointest Endosc. 2012. PMID: 22854058
-
Influence of early colorectal cancer component on the positive margins after endoscopic resection: a retrospective study.BMC Cancer. 2022 Jan 29;22(1):120. doi: 10.1186/s12885-021-09159-8. BMC Cancer. 2022. PMID: 35093004 Free PMC article.
Cited by
-
Endoscopic Resection Techniques for Widespread Precancerous Lesions and Early Carcinomas in the Rectum.J Clin Med. 2025 May 9;14(10):3322. doi: 10.3390/jcm14103322. J Clin Med. 2025. PMID: 40429318 Free PMC article. Review.
-
Endoscopic Full Thickness Resection Device (FTRD®) for the Management of Gastrointestinal Lesions: Current Evidence and Future Perspectives.Diagnostics (Basel). 2025 Apr 4;15(7):932. doi: 10.3390/diagnostics15070932. Diagnostics (Basel). 2025. PMID: 40218282 Free PMC article. Review.
References
Publication types
MeSH terms
LinkOut - more resources
Full Text Sources
Research Materials
Miscellaneous

