Secapin: a promising antimicrobial peptide against multidrug-resistant Acinetobacter baumannii
- PMID: 39224503
- PMCID: PMC11367255
- DOI: 10.3205/dgkh000491
Secapin: a promising antimicrobial peptide against multidrug-resistant Acinetobacter baumannii
Abstract
Introduction: Acinetobacter baumannii, renowned for its exceptional multidrug resistance and its role as a prevalent nosocomial pathogen, poses a formidable challenge to conventional antibiotic therapies. The primary objective of this investigation was to evaluate the efficacy of Secapin, an antimicrobial peptide, against multidrug-resistant (MDR) baumannii. Furthermore, the mechanisms underlying Secapin's antibacterial and antibiofilm activities were elucidated.
Methods: The antimicrobial and antibiofilm effectiveness of Secapin against MDR A. baumannii was assessed through a series of experiments. The minimum inhibitory concentration (MIC) and minimum bactericidal concentration (MBC) of Secapin were determined using established protocols. Time-kill kinetic analysis was performed to assess the concentration-dependent bactericidal effect of Secapin. Additionally, the capacity of Secapin to impede biofilm formation and eradicate A. b aumannii biofilms was investigated. Hemolytic potential was evaluated using human red blood cells, while mammalian cell viability was examined at varying Secapin concentrations.
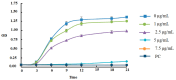
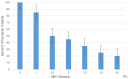
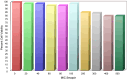
Results: Secapin exhibited robust bactericidal activity at minimal concentrations, with an MIC of 5 µg/mL and an MBC of 10 µg/mL against MDR A. baumannii. The time-kill kinetic analysis confirmed the concentration-dependent efficacy of Secapin in diminishing bacterial viability. Moreover, Secapin demonstrated the ability to prevent biofilm formation and eliminate established A. baumannii biofilms. Notably, Secapin exhibited no hemolytic activity and preserved mammalian cell viability up to a concentration of 100 µg/mL.
Conclusion: These findings underscore the substantial potential of Secapin as a potent agent against multidrug-resistant A. baumannii, showcasing its efficacy in both antibacterial and antibiofilm capacities. The favorable attributes of Secapin, characterized by its minimal hemolytic effects and high mammalian cell viability, position it as a promising contender in the fight against antibiotic resistance.
Hintergrund: Acinetobacter baumannii, bekannt für seine außergewöhnliche Multiresistenz und seine Rolle als häufiger nosokomialer Erreger, stellt eine Herausforderung für herkömmliche Antibiotikabehandlungen dar. Das Hauptziel dieser Studie war es, die Wirksamkeit von Secapin, einem antimikrobiellen Peptid, gegen multiresistente A. baumannii zu bewerten. Darüber hinaus wurden die Mechanismen, durch die Secapin seine antibakterielle und antibiofilmbildende Aktivitäten entfaltet, aufgeklärt.
Methoden: Die antimikrobielle und antibiofilmbildende Wirksamkeit von Secapin gegen MDR A. baumannii wurde in einer Reihe von Experimenten untersucht. Die minimale Hemmkonzentration (MIC) und die minimale bakterizide Konzentration (MBC) von Secapin wurden unter Verwendung etablierter Protokolle bestimmt. Es wurde eine zeitabhängige Abtötungskinetik ermittelt, um die konzentrationsabhängige bakterizide Wirkung von Secapin zu bewerten. Darüber hinaus wurde die Fähigkeit von Secapin, die Bildung von Biofilmen zu hemmen und etablierte A. baumannii-Biofilme zu beseitigen, untersucht. Das hämolytische Potenzial wurde unter Verwendung von menschlichen roten Blutkörperchen bewertet, während die Lebensfähigkeit von Säugetierzellen bei verschiedenen Secapin-Konzentrationen untersucht wurde.
Ergebnisse: Secapin zeigte eine starke bakterizide Aktivität bei geringen Konzentrationen mit einer MIC von 5 µg/mL und einer MBC von 10 µg/mL gegen MDR A. baumannii. Die zeitabhängige Abtötungskinetik bestätigte die konzentrationsabhängige Wirksamkeit von Secapin. Darüber hinaus zeigte Secapin die Fähigkeit, die Bildung von Biofilmen zu verhindern und etablierte A. baumannii-Biofilme zu eliminieren. Bemerkenswert ist, dass Secapin keine hämolytische Aktivität aufwies und die Lebensfähigkeit von Säugetierzellen bis zu einer Konzentration von 100 µg/mL aufrechterhielt.
Fazit: Die Ergebnisse unterstreichen das erhebliche Potenzial von Secapin als wirksames Mittel gegen multiresistente A. baumannii sowohl in Bezug auf seine antibakterielle als auch antibiofilmbildende Aktivität. Die vorteilhaften Eigenschaften von Secapin, gekennzeichnet durch seine geringen hämolytischen Effekte und hohe Verträglichkeit gegenüber Säugetierzellen, positionieren es als vielversprechenden Kandidaten im Kampf gegen Antibiotikaresistenzen.
Keywords: Acinetobacter baumannii; Secapin; antibiofilm; antimicrobial; bactericidal; cell compatibility.
Copyright © 2024 Sadeghi Rad et al.
Conflict of interest statement
The authors declare that they have no competing interests.
Figures




Similar articles
-
Antimicrobial and Anti-Biofilm Peptide Octominin for Controlling Multidrug-Resistant Acinetobacter baumannii.Int J Mol Sci. 2021 May 19;22(10):5353. doi: 10.3390/ijms22105353. Int J Mol Sci. 2021. PMID: 34069596 Free PMC article.
-
Novel Antimicrobial Peptide "Octoprohibitin" against Multidrug Resistant Acinetobacter baumannii.Pharmaceuticals (Basel). 2022 Jul 27;15(8):928. doi: 10.3390/ph15080928. Pharmaceuticals (Basel). 2022. PMID: 36015076 Free PMC article.
-
The human antimicrobial peptide LL-37 and its fragments possess both antimicrobial and antibiofilm activities against multidrug-resistant Acinetobacter baumannii.Peptides. 2013 Nov;49:131-7. doi: 10.1016/j.peptides.2013.09.007. Epub 2013 Sep 23. Peptides. 2013. PMID: 24071034
-
Antibacterial Properties and Efficacy of LL-37 Fragment GF-17D3 and Scolopendin A2 Peptides Against Resistant Clinical Strains of Staphylococcus aureus, Pseudomonas aeruginosa, and Acinetobacter baumannii In Vitro and In Vivo Model Studies.Probiotics Antimicrob Proteins. 2024 Jun;16(3):796-814. doi: 10.1007/s12602-023-10070-w. Epub 2023 May 6. Probiotics Antimicrob Proteins. 2024. PMID: 37148452
-
Octopromycin: Antibacterial and antibiofilm functions of a novel peptide derived from Octopus minor against multidrug-resistant Acinetobacter baumannii.Fish Shellfish Immunol. 2021 Oct;117:82-94. doi: 10.1016/j.fsi.2021.07.019. Epub 2021 Jul 23. Fish Shellfish Immunol. 2021. PMID: 34311097
Cited by
-
BOL Lectin: A Protein Derived from Cauliflower Exhibits Antibiofilm Activity in In Vitro Assays Against Staphylococcus aureus.Microorganisms. 2025 Aug 15;13(8):1901. doi: 10.3390/microorganisms13081901. Microorganisms. 2025. PMID: 40871405 Free PMC article.
References
-
- Venkateswaran P, Vasudevan S, David H, Shaktivel A, Shanmugam K, Neelakantan P, Solomon AP. Revisiting ESKAPE Pathogens: virulence, resistance, and combating strategies focusing on quorum sensing. Front Cell Infect Microbiol. 2023 Jun 29;13:1159798. doi: 10.3389/fcimb.2023.1159798. - DOI - PMC - PubMed
LinkOut - more resources
Full Text Sources
Molecular Biology Databases

