Kidney effects of Glucagon-Like Peptide 1 (GLP1): from molecular foundations to a pharmacophysiological perspective
- PMID: 39514688
- PMCID: PMC11548866
- DOI: 10.1590/2175-8239-JBN-2024-0101en
Kidney effects of Glucagon-Like Peptide 1 (GLP1): from molecular foundations to a pharmacophysiological perspective
Abstract
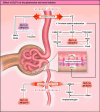
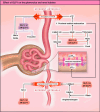
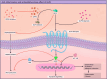
GLP1 receptor agonists (GLP1-RAs) are drugs that mimic the effects of the incretin hormone GLP1 and were initially introduced in medicine for the treatment of diabetes in 2005 and for obesity in 2014. Over time, data from secondary and exploratory objectives of large randomized controlled-trials suggested that GLP1-RAs could also exert renal action by slowing the progression of kidney disease in patients with and without diabetes. Based on this rationale, the Flow study (1 mg semaglutide vs placebo) was designed and recruitment began in 2019 until May 2021. The recently published results confirmed the effect of semaglutide in reducing the composite renal outcome. However, similar to SGLT2 inhibitors, the potential mechanisms behind the renal effects of GLP1-RAs still need to be elucidated. The aim of this review is to address the different physiological mechanisms of GLP1-RAs at the renal level, using evidence from experimental studies and current scientific literature.
Resumo: Os agonistas do receptor de GLP1 (GLP1-RAs) são medicamentos que imitam os efeitos do hormônio incretínico GLP1. Eles foram inicialmente introduzidos na medicina para o tratamento do diabetes em 2005 e para a obesidade em 2014. Com o passar do tempo, dados provenientes de objetivos secundários e exploratórios de amplos ensaios clínicos randomizados sugeriram que os GLP1-RAs também poderiam exercer ação renal ao retardar a progressão da doença renal em pacientes com e sem diabetes. Com base nesse raciocínio, o estudo Flow (semaglutida 1 mg vs. placebo) foi desenhado e o recrutamento começou em 2019, estendendo-se até maio de 2021. Os resultados publicados recentemente confirmaram o efeito da semaglutida na redução do desfecho renal composto. No entanto, assim como os inibidores do SGLT2, os mecanismos potenciais por trás dos efeitos renais dos GLP1-RAs ainda precisam ser elucidados. O objetivo desta revisão é abordar os diferentes mecanismos fisiológicos dos GLP1-RAs em nível renal, utilizando evidências de estudos experimentais e da literatura científica atual.
Conflict of interest statement
The authors declare that they have no conflict of interest related to the publication of this manuscript.
Jorge Rico Fontalvo declares that he has received honoraria for conferences from Astra Zeneca, Boehringer Ingelheim, Novo Nordisk, Lilly, Sanofi, Novartis, Abbvie, Merck y Bayer. And participated on Advisory Board for AZ, Boehringer Ingelheim, Bayer y Novo Nordisk.
Maria Jose Soler declares that she has received honoraria for conferences and consulting fees from Novo Nordisk, Jansen, Mundipharma, AstraZeneca, Esteve, Fresenius, Eli Lilly, Boehringer-Ingelheim, Vifor, ICU, Pfizer, Bayer, Travere Therapeutics, GE Healthcare, GSK and Otsuka. She is also one of the former Editors-in-Chief of CKJ. Current editorial board of American Society of Nephrology (ASN) journals.
Thyago Moraes declares that he has received honoraria for conferences from AstraZeneca, Baxter, Bayer, Boehringer, Lilly, Novo Nordisk and Takeda; and participated on advisory board for AstraZeneca, Baxter, Bayer, Boehringer and Lilly.
Rodrigo Daza Arnedo declares that he has received honoraria for conferences from Astra Zeneca, Boehringer Ingelheim, Novo Nordisk y Bayer. Participated in Advisory Board for AZ, Boehringer Ingelheim, Bayer y Novo Nordisk.
The other authors declare no conflict of interest.
Figures



References
-
- Park MK. In: Handbook of hormones: comparative endocrinology for basic and clinical research. Takei Y, Ando H, Tsutsui K, editors. Oxford: Elsevier; 2016. Glucagon-like peptide-2. In: pp. 138–139. - DOI
Publication types
MeSH terms
Substances
LinkOut - more resources
Full Text Sources

