[Monoclonal Antibodies in Allergic Diseases: Development, Pharmacology, and Clinical Applications]
- PMID: 39670906
- PMCID: PMC11905782
- DOI: 10.31053/1853.0605.v81.n4.44413
[Monoclonal Antibodies in Allergic Diseases: Development, Pharmacology, and Clinical Applications]
Abstract
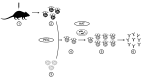
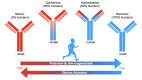
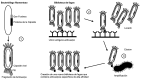
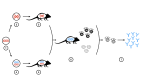
The understanding of immunological processes associated with allergic diseases and advancements in antibody bioengineering has driven the development of specific biological therapies. Monoclonal antibodies, selectively targeting cytokines involved in the pathogenesis of allergic processes or their receptors, have emerged as a promising tool in treating various conditions, including asthma, allergic rhinitis, urticaria, and severe atopic dermatitis. Since the approval of the first anti-CD3 mouse monoclonal antibody in 1986, remarkable progress has been achieved, marked by the development of chimeric, 'humanized,' and 'fully human' antibodies. The 'humanization' of monoclonal antibodies has played a crucial role in reducing the risk of immunogenicity and minimizing adverse effects, thereby notably enhancing the safety and efficacy of these therapeutic interventions. The aim of this article is to address the characterization, development, pharmacokinetics, pharmacodynamics, and clinical utility of monoclonal antibodies, with a primary focus on allergic diseases.
El avance en la comprensión de los procesos inmunológicos relacionados con enfermedades alérgicas y en la bioingeniería de anticuerpos ha propiciado el desarrollo de terapias biológicas específicas. Los anticuerpos monoclonales, dirigidos selectivamente hacia citocinas involucradas en la patogénesis de los procesos alérgicos, o sus receptores, han emergido como una herramienta prometedora en el tratamiento de diversas afecciones, tales como el asma, la rinitis alérgica, la urticaria y la dermatitis atópica grave. Desde la aprobación del primer anticuerpo monoclonal anti-CD3 de origen murino en 1986, se ha transitado un largo recorrido, caracterizado por la aparición de anticuerpos quiméricos, los que por estructura molecular de la inmunoglobulina es semejante a los del ser humano denominados "humanizados" y los exactamente iguales llamados "completamente humanos". La "humanización" de los anticuerpos monoclonales ha contribuido significativamente a reducir tanto el riesgo de inmunogenicidad como la incidencia de efectos adversos, mejorando notablemente la seguridad y eficacia de estas terapias. Este artículo tiene como objetivo abordar la caracterización, desarrollo, farmacocinética, farmacodinamia y utilidad clínica de los anticuerpos monoclonales, principalmente focalizados en las enfermedades alérgicas.
Keywords: immunoglobulins; hypersensitivity; asthma; allergic rhinitis; pharmacology.
Universidad Nacional de Córdoba
Conflict of interest statement
Ninguno.
Figures
References
Publication types
MeSH terms
Substances
LinkOut - more resources
Full Text Sources
Medical
