Standardization of the use of opsonized zymosan as stimulus in the 1,2,3-dihydrorhodamine technique for the assessment of neutrophil respiratory burst
- PMID: 39836849
- PMCID: PMC12014214
- DOI: 10.7705/biomedica.7461
Standardization of the use of opsonized zymosan as stimulus in the 1,2,3-dihydrorhodamine technique for the assessment of neutrophil respiratory burst
Abstract
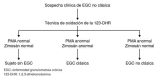
Introduction: Chronic granulomatous disease is a defect in phagocytosis due to deficiency of gp91phox, p22phox, p47phox, p40phox, and p67phox (classic form of the disease). Recently, EROS and p40phox deficiency were described as responsible for the non-classical form of the disease. The 1,2,3-dihydrorhodamine oxidation technique, with phorbol-12-myristate-13-acetate as a stimulus, is performed to diagnose the classic chronic granulomatous disease. However, oxidation mediated by EROS and p40phox requires stimuli such as zymosan, Escherichia coli, or Staphylococcus aureus.
Objective: To optimize the 1,2,3-dihydrorhodamine technique using zymosan to assess neutrophil respiratory burst and detect the non-classical chronic granulomatous disease.
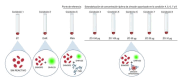
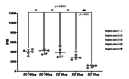
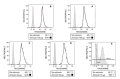
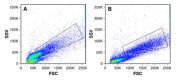
Materials and method: Blood was obtained from five healthy subjects after the signature of the informed consent. The 1,2,3-dihydrorhodamine technique was performed with phorbol-12-myristate-13-acetate as control and different quantities of opsonized zymosan (150, 100, 50, 20, and 10 μg). We obtained through flow cytometry the mean fluorescence intensity of rhodamine 1,2,3 oxidated in the neutrophil population and calculated the oxidation index. The Kolmogorov-Smirnov test, ANOVA, and Tukey’s post-hoc analysis were used. We considered a p value ≤ 0.05 as statistically significant.
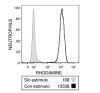
Results: The phorbol-12-myristate-13-acetate increased the rhodamine 1,2,3 mean fluorescence intensity in healthy subjects. Among the different zymosan conditions tested, we selected 50 μg as the optimal and reproducible amount in all controls according to the statistical analysis and cytometric findings.
Conclusions: We present the optimization of the 1,2,3-dihydrorhodamine technique using zymosan. We propose its implementation in clinical diagnostic laboratories to expand the diagnosis of chronic granulomatous disease.
Introducción: La enfermedad granulomatosa crónica es un defecto de la fagocitosis por deficiencia de gp91phox, p22phox, p47phox, p40phox y p67phox (forma clásica). Recientemente, se describió la deficiencia de EROS y p40phox como responsables de la forma no clásica. La técnica de oxidación de la 1,2,3-dihidrorrodamina –usando como estímulo el forbol-12-miristato-13-acetato– se utiliza para el diagnóstico de la enfermedad granulomatosa crónica clásica. Sin embargo, para la detección de la oxidación mediada por EROS y p40phox, se requiere de otros estímulos como zimosán, Escherichia coli o Staphylococcus aureus.
Objetivo: Estandarizar el estímulo con zimosán en la técnica de la 1,2,3-dihidrorrodamina para evaluar el estallido respiratorio del neutrófilo.
Materiales y métodos: Se obtuvo sangre de cinco sujetos sanos previo consentimiento informado. Se utilizó la técnica de 1,2,3-dihidrorrodamina usando el forbol-12-miristato-13-acetato como control y diferentes cantidades de zimosán opsonizado (150, 100, 50, 20 y 10 μg). Por citometría de flujo, se obtuvo la intensidad de fluorescencia media de la rodamina 1,2,3 en las poblaciones de neutrófilos y se calculó el índice de oxidación. Se utilizaron las pruebas de Kolmogorov-Smirnov, ANOVA y el análisis post-hoc de Tukey. Se consideró un valor de p ≤ 0,05 como estadísticamente significativo.
Resultados: El forbol-12-miristato-13-acetato incrementó la intensidad de la fluorescencia media de la rodamina 1,2,3 en los sujetos sanos. Entre las diferentes condiciones de zimosán probadas, la de 50 μg fue la cantidad óptima y reproducible en todos los controles por el análisis estadístico y los hallazgos citométricos.
Conclusiones: Se presenta la optimización de la técnica 1,2,3-dihidrorrodamina empleando el zimosán como estímulo.
Keywords: granulomatous disease; chronic; rhodamine 1,2,3; zymosan; NADPH oxidase.
Conflict of interest statement
Figures
Similar articles
-
Diagnosis and carrier detection of chronic granulomatous disease in five families by flow cytometry.Int Arch Allergy Immunol. 1997 Oct;114(2):144-52. doi: 10.1159/000237660. Int Arch Allergy Immunol. 1997. PMID: 9338608
-
Downregulation of neutrophil CD43 by opsonized zymosan.Blood. 1995 Jan 15;85(2):337-42. Blood. 1995. PMID: 7811990
-
Oxidative burst assessment and neutrophil-platelet complexes in unlysed whole blood.J Immunol Methods. 2008 Dec 31;339(2):124-31. doi: 10.1016/j.jim.2008.09.003. Epub 2008 Sep 25. J Immunol Methods. 2008. PMID: 18823984
-
Delayed Blood Processing Leads to Rapid Deterioration in the Measurement of the Neutrophil Respiratory Burst by the Dihydrorhodamine-123 Reduction Assay.Cytometry B Clin Cytom. 2019 Sep;96(5):389-396. doi: 10.1002/cyto.b.21767. Epub 2019 Feb 7. Cytometry B Clin Cytom. 2019. PMID: 30734466
-
Intersecting Stories of the Phagocyte NADPH Oxidase and Chronic Granulomatous Disease.Methods Mol Biol. 2019;1982:3-16. doi: 10.1007/978-1-4939-9424-3_1. Methods Mol Biol. 2019. PMID: 31172463 Review.
References
-
- Matute JD, Arias AA, Wright NA, Wrobel I, Waterhouse CC, Li XJ, et al. A new genetic subgroup of chronic granulomatous disease with autosomal recessive mutations in p40phox and selective defects in neutrophil NADPH oxidase activity. Blood. 2009;114:3309–3315. doi: 10.1182/blood-2009-07-231498. - DOI - PMC - PubMed
Publication types
MeSH terms
Substances
LinkOut - more resources
Full Text Sources