ADN tumoral circulante en pacientes con cáncer: perspectivas desde el laboratorio clínico
- PMID: 40977810
- PMCID: PMC12446924
- DOI: 10.1515/almed-2025-0093
ADN tumoral circulante en pacientes con cáncer: perspectivas desde el laboratorio clínico
Abstract
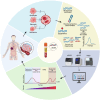
El análisis de ADN tumoral circulante (ctDNA) es un método no invasivo de gran relevancia para la caracterización molecular de los tumores sólidos, que aporta información valiosa sobre el perfil genético del cáncer. Actualmente, el análisis de mutaciones somáticas del ctDNA se emplea en la clínica para la selección de terapias dirigidas en enfermedades oncológicas avanzadas. Avances recientes también han revelado su potencial en la detección precoz, el pronóstico y la evaluación de enfermedad mínima residual, así como en la predicción y el seguimiento de la respuesta a terapia. En los últimos años, se han logrado importantes avances en el desarrollo de diversos métodos basados tanto en la secuenciación de nueva generación (NGS, por sus siglas en inglés) como en la realización de PCR para detectar variantes genéticas en el ctDNA de los pacientes oncológicos. Sin embargo, a pesar de las novedosas oportunidades que brinda el análisis de ctDNA, este aún presenta algunas limitaciones. La falta de normalización de los protocolos preanalíticos y analíticos y de la interpretación de los resultados, así como la heterogeneidad en la sensibilidad de las pruebas siguen siendo una asignatura pendiente que deberá ser abordada antes de impulsar un uso generalizado de las pruebas de ctDNA en la clínica. Además de las mutaciones somáticas, se están obteniendo resultados prometedores en estudios sobre la metilación del ADN (epigenómica) y el tamaño de los fragmentos de ADN (fragmentómica) en diversos tipos de fluidos biológicos como biomarcadores no invasivos para el manejo del cáncer. En la presente revisión, se describen las aplicaciones clínicas de las variantes genéticas somáticas en el ctDNA, haciendo hincapié en los biomarcadores del cáncer, y enumerando los factores esenciales para lograr una implementación eficaz en el laboratorio clínico y en el manejo de las enfermedades oncológicas.
Figures
References
-
- Alix-Panabières C, Pantel K. Liquid biopsy: from discovery to clinical application. Cancer Discov. 2021;11:858–73. doi: 10.1158/2159-8290.cd-20-1311. - DOI - PubMed
-
- Pascual J, Attard G, Bidard F-C, Curigliano G, De Mattos-Arruda L, Diehn M, et al. ESMO recommendations on the use of circulating tumour DNA assays for patients with cancer: a report from the ESMO Precision Medicine Working Group. Ann Oncol OffJ Eur Soc Med Oncol. 2022;33:750–68. doi: 10.1016/j.annonc.2022.05.520. - DOI - PubMed
-
- Ruiz-Bañobre J, Rodriguez-Casanova A, Costa-Fraga N, Bao-Caamano A, Alvarez-Castro A, Carreras-Presas M, et al. Noninvasive early detection of colorectal cancer by hypermethylation of the LINC00473 promoter in plasma cell-free DNA. Clin Epigenet. 2022;14:86. doi: 10.1186/s13148-022-01302-x. - DOI - PMC - PubMed
LinkOut - more resources
Full Text Sources
